6.某些盐溶液的配制、保存
在配制FeCl3、AlCl3、CuCl2、SnCl2等溶液时为防止水解,常先将盐溶于少量相应的酸中,再加蒸馏水稀释到所需浓度.
Na2SiO3、Na2CO3、NH4F等不能贮存磨口玻璃塞的试剂瓶中,因Na2SiO3、Na2CO3水解呈碱性,产生较多OH—,NH4F水解产生HF,OH—、HF均能腐蚀玻璃.
7.某些离子间因发生又水解而在溶液中不大量共存,如
①Al3+与S2—、HS—、CO32—、HCO3—、AlO2,SiO32—、ClO—、C6H5O—等不共存
②Fe3与CO32—、HCO3—、AlO2—、ClO—等不共存
![]() ③NH4+与ClO—、SiO32—、AlO2—等不共存
③NH4+与ClO—、SiO32—、AlO2—等不共存
想一想:Al2S3为何只能用干法制取?(2Al+2S Al2S3)
小结:能发生双水解反应,首先是因为阴、阳离子本身单一水解程度相对较大,其次水解一方产生较多,H+,另一方产生较多OH—,两者相互促进,使水解进行到底。
例如:
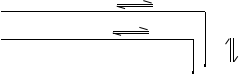 3HCO3— + 3H2O 3H2CO3 + 3OH—
3HCO3— + 3H2O 3H2CO3 + 3OH—
Al3+ + 3H2O Al(OH)3 + 3H+
促进水解进行到底
总方程式: 3H2O
3HCO3—+Al3+===Al(OH)3↓+3CO2↑
8.泡沫灭火器内反应原理.
NaHCO3和Al2(SO4)3混合可发生双水解反应: 2HCO3—+Al3+==Al(OH3)↓+3CO2↑
生成的CO2将胶状Al(OH)3吹出可形成泡沫
9.制备胶体或解释某些盐有净水作用
FeCl3、Kal2(SO4)2·12H2O等可作净水剂.
原因:Fe3+、Al3+水解产生少量胶状的Fe(OH)3、Al(OH)3,结构疏松、表面积大、吸附能力强,故它们能吸附水中悬浮的小颗粒而沉降,从而起到净水的作用.
10.某些化学肥料不能混合使用
如铵态(NH4+)氮肥、过磷酸钙[含Ca(HPO4)2]均不能与草木灰(主要成分K2CO3)
混合使用.2NH4++CO32—==2NH3↑+CO2↑+H2O
↑
损失氮的肥效
Ca2++2H2PO4—+2CO32—== CaHPO4↓+2HCO3—+HPO42—
难溶物,不能被值物吸收
11.热的纯碱液去油污效果好.
加热能促进纯碱Na2CO3水解,产生的[OH—]较大,而油污中的油脂在碱性较强的条件下,水解受到促进,故热的比不冷的效果好.
12.在NH4Cl溶液中加入Mg粉,为何有H2放出?
![]() NH4++H2O NH3·H2O+H+
NH4++H2O NH3·H2O+H+
Mg+2H+===Mg2++H2↑
13.除杂
例:除去MgCl2溶液中的Fe3+可在加热搅拌条件下,加入足量MgO或MgCO3或Mg(OH)2,搅拌充分反应,后过滤除去。
想一想:为何不能用NaOH或Na2CO3等溶液?
3.例题精讲
例2若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能
A.生成一种强酸弱碱盐 B.弱酸溶液和强碱溶液
C.弱酸与弱碱溶液反应 D.一元强酸溶液与一元强碱溶液反应
答案:B
例3下列反应的离子方程式正确的是
A.硫酸铝溶液和小苏打溶液反应 Al3++3HCO3-==3CO2↑+Al(OH)3↓
B.向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+ SO2+ H2O == CaSO3¯+2HClO
C.硫化亚铁中加入盐酸 S2-+2H+==H2S↑
D.钠和冷水反应Na+2H2O==Na++H2↑+2OH-
答案:A。
例4.明矾溶于水所得溶液中离子浓度关系正确的是( )
A.[SO42—]=[K+]=[Al3+]>[H+]>[OH—]
B.[SO42—]>2[K+]>[Al3+]>[OH—] >[H+]
C.![]() [SO42—]>2[K+]>[Al3+]>[OH—] >[H+]
[SO42—]>2[K+]>[Al3+]>[OH—] >[H+]
D.[SO42—]+[OH—]=[K+]+[Al3+]+[H+]
4.实战演练
一、选择题
1. 常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中
A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+) C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系
2.在常温下10 mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+)B.c(H+)=c(OH-)<c(K+)<c(A-)C.V后≥20 mLD.V后≤20 mL
3.物质的量浓度相同(0.1 mol·L-1)的弱酸HX与NaX溶液等体积混合后,溶液中粒子浓度关系错误的是
A.c(Na+)+c(H+)=c(X-)+c(OH-)
B.若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C.c(HX)+c(X-)=2c(Na+)
D.若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
4.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)>c(X-),则下列关系正确的是
A.c(OH-)<c(H+) B.c(HX)<c(X-)
C.c(X-)+c(HX)=2c(Na+) D.c(HX)+c(H+)=c(Na+)+c(OH-)
5.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是
A.H2Y的电离方程式为:H2Y+H2O![]() H3O++HY-
H3O++HY-
B.在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.HY-的水解方程式为HY-+H2O![]() H3O++Y2-
H3O++Y2-
D.在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+)
6.将0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后,溶液显酸性,则溶液中有关粒子的浓度关系正确的是
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)B.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)D.c(Na+)+c(H+)>c(CH3COO-)+c(Cl-)+c(OH-)
7.物质的量浓度相同的下列溶液中,NH![]() 浓度****的是
浓度****的是
A.NH4NO3 B.NH4HSO4C.CH3COONH4 D.NH4HCO3
8.CH3COOH与CH3COONa以等物质的量混合配制成的稀溶液,pH为4.7,下列说法错误的是
A.CH3COOH的电离作用大于CH3COONa的水解作用B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解 D.CH3COONa的存在抑制了CH3COOH的电离
9.已知0.1 mol·L-1的NaHCO3溶液的pH=8,同浓度的NaAlO2溶液的pH=11,将两种溶液等体积混合,并且发生了反应,可能较大量生成的物质是
A.CO2 B.Al(OH)3 C.CO![]() D.Al3+
D.Al3+
