第Ⅱ部分 非选择题(共52分)
二、填空题 (共46分)
17.(7分)⑴ 写出下列物质在水溶液中发生水解的离子方程式:
Na2CO3
KAl (SO4)2
⑵ 纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s) +1/2 O2(g) === Cu2O(s) ΔH=-169 kJ·mol-1,
C(s) + 1/2O2(g) === CO(g) ΔH=-110.5 kJ·mol-1,
2Cu(s) + O2(g)=== 2CuO (s) ΔH=-314 kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
。
18.(14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
 (2)滴定时边滴边摇动锥形瓶,眼睛应观察
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是
由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)右图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
|
滴定次数 |
待测液体积mL) |
标准盐酸体积(mL) | |
|
滴定前读数(mL) |
滴定后读数(mL) | ||
|
第一次 |
25.00 |
0.50 |
20.40 |
|
第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度: mol/L
19.(14分)在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:
2X(g)+Y(g)![]() 2Z(g);△H<0
2Z(g);△H<0
 若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
(1)平衡时Z的物质的量为___________;若反应经历5min达到平衡,则Y的平均反应速率为____________。
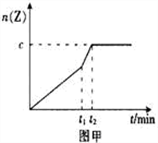
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图像如图甲。
A.升温 B.降温 C.加压 D.减压 E.加催化剂
若c=0.90mol,t1时刻改变的条件是_________(填选项编号,下同),t2_______5min (填“>”,“<”或“=”下同)。
 (3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量______0.9mol (填“>”,“<”或“=”)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量______0.9mol (填“>”,“<”或“=”)。
(4)若将物质的量均为3.00mol物质X、Y混合于5L容器中发生反应,
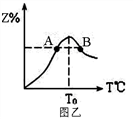
在反应过程中Z的物质的量分数随温度变化如图乙。
①A、B两点Z物质正反应速率的大小关系是_________;
② 温度T<T0时,Z%逐渐增大的原因是______________。
20.(11分)(1)室温下,pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
① 如果加入蒸馏水,应加_________mL;
② 如果加入pH=10的NaOH溶液,应加_________mL;
(2)在一定温度下,现有浓度都为0.1 mol·L-1 a.盐酸,b.硫酸,c.醋酸 d.氨水 四种溶液:
① 四种溶液的pH由大到小的顺序是 。(用字母编号填答)
② 为了证明一水合氨(NH3·H2O)是弱电解质,甲取pH试纸湿润后测得该氨水pH为11,则认定一水合氨是弱电解质,你认为这一方法是否正确?(填“是”或“否”) ,并说明理由: 。
③ 当这三种酸溶液体积相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。(用字母编号填答)
三、计算题(共6分)
21.(6分)一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知CO(g)和H2O(g) 的起始浓度均为2 mol·L-1, 经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g) 的起始浓度均为2 mol·L-1, 经测定该反应在该温度下的平衡常数K=1,试判断:
(1) 当CO转化率为25%时,该反应是否达到平衡?若未达到平衡,向哪个方向进行?
(2) 达到平衡时,CO的转化率为多少?
(3) 当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
17.(7分)(1)CO32—+H2O![]() HCO3—+OH— (2分)
HCO3—+OH— (2分)
Al3++3H2O![]() 3Al(OH)3+3H+ (2分)
3Al(OH)3+3H+ (2分)
(2)C(s) + 2CuO (s)= CuO(s) + CO(g) ![]() H =+34.5kJ·mol.-1(3分)
H =+34.5kJ·mol.-1(3分)

20.(11分)
(1)0.9mol (2分) 0.045 mol・L-1・min-1(2分)
(2)E(1分); < (1分)
(3)>(2分)
(4)①B>A;(1分)
②反应未达到平衡,反应仍在向正反应方向进行,故Z%的逐渐增大。(2分)
21.(11分)(1)900 1000 81.8
(2)①d>c>a>b
②否 因为湿润的PH试纸稀释了氨水,也会导致测PH减小
③b>a=c
22.(6分)
(1)反应未达到平衡,Q=1/9<k=1,平衡向正反应方向进行(2分)
(2)50%(2分) (3)75%(2分)
