1.(2015·黄冈月考)下列选项中的物质所含指定原子数目一定相等的是( )
A.温度和压强不同,相同质量的N2O和CO2两种气体的总原子数
B.等温等压下,相同体积的C2H4和C2H2、C2H6的混合气体的总原子数
C.等温等压下,相同体积的O2和O3两种气体中的氧原子数
D.相同物质的量、不同体积的NH3和CH4两种气体中的氢原子数
解析:选A。质量相等,N2O和CO2的摩尔质量也相等,则气体的物质的量相等,且两者都是三原子分子,所以它们的总原子数一定相等,A项正确;B项中,碳原子数相等,但是C2H2和C2H6的组成比例不确定,不能判断氢原子数是否相等,B项错误;两种气体的物质的量相等,但两种气体的分子组成不同,故氧原子数不同,C项错误;D项,物质的量相等的NH3和CH4中氢原子数不同,D项错误。
2.(2015·豫东豫北联考)同温同压下,等体积的两容器内分别充满由14N、
A.分子数和气体质量均不同
B.分子数和电子数均相同
C.质子数和中子数均相同
D.分子数、原子数和中子数均相同
解析:选D。由阿伏加德罗定律可知,同温同压下,相同体积的气体具有相同的分子数,故这两种气体的分子数相同。A项,分子数相同,但二者的摩尔质量不同,故质量不同,A错误;B项,分子数相同,但电子数不同,B错误;C项,质子数不同,中子数相同,C错误;D项,分子数相同,又NO和CO都是双原子分子,故原子数相同,且两种气体分子的中子数都为17,正确。
3.(2015·河北衡水调研)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,
B.在标准状况下,
C.200 mL 1 mol/L的Al2(SO4)3溶液中,Al3+和SO离子总数为NA
D.标准状况下,Na2O2与足量CO2反应生成
解析:选A。A项甲醛和乙酸的最简式均为CH2O,
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,
B.标准状况下,当活泼金属转移2NA个电子时,可从盐酸中置换出
C.
D.1 mol H2O2分子中非极性共价键数为NA
解析:
5.NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol乙酸和1 mol乙醇充分反应生成的水分子数为NA
B.0.1 mol/L碳酸钠溶液中阴离子总数大于0.1NA
C.
D.常温常压下,
解析:选D。乙酸和乙醇发生酯化反应生成乙酸乙酯和水,该反应是可逆反应,反应不能进行到底,故1 mol乙酸和1 mol乙醇充分反应后生成的水分子数小于NA,A项错误;只给浓度无体积,无法计算,B项错误;
6.(2015·唐山期末)用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.等质量的N2和CO所含分子数均为NA
B.在标准状况下,
C.一定温度下,
D.1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
解析:选B。N2和CO的摩尔质量相等,等质量的N2和CO所含分子数相等,但不一定是NA,A项错误;标准状况下
7.氧可与多种元素形成化合物,设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.
B.
C.
D.标准状况下,将
解析:选B。
8.(2015·江苏徐州检测)如图表示
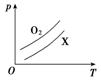
A.C2H4 B.CH4
C.CO2 D.NO
解析:选C。由图可知,相同温度时,p(O2)>p(X),在同质量、同体积条件下,气体相对分子质量与压强成反比,即相对分子质量越大,压强越小。只有CO2的相对分子质量大于O2的,故C正确。
9.某液体化合物X2Y4,常用作火箭燃料。
(1)反应前O2的体积(标准状况下)为______________。
(2)X2的摩尔质量为________;Y元素的名称是________。
(3)若反应生成0.1 mol X2,则转移电子的物质的量为________mol。
解析:(1)根据化学方程式,参加反应的O2与生成的X2的物质的量相等。根据阿伏加德罗定律,则参加反应的O2也为
(2)生成的X2的质量为
(3)由化学方程式可知每生成1 mol X2转移4 mol e-,则生成0.1 mol X2转移电子0.4 mol。
答案:(1)
