盐类的水解
1.复习重点
1.盐类的水解原理及其应用
2.溶液中微粒间的相互关系及守恒原理
2.难点聚焦
(一) 盐的水解实质
 当盐AB能电离出弱酸阴离子(Bn—)或弱碱阳离子(An+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.
当盐AB能电离出弱酸阴离子(Bn—)或弱碱阳离子(An+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.
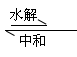
与中和反应的关系:盐+水 酸+碱(两者至少有一为弱)
由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是****以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律
简述为:有弱才水解,无弱不水解 越弱越水解,弱弱都水解 谁强显谁性,等强显中性
具体为:
1.正盐溶液
①强酸弱碱盐呈酸性 ②强碱弱酸盐呈碱性 ③强酸强碱盐呈中性④弱酸碱盐不一定
2.酸式盐
①若只有电离而无水解,则呈酸性(如NaHSO4)
②若既有电离又有水解,取决于两者相对大小
电离程度>水解程度,呈酸性
电离程度<水解程度,呈碱性
强碱弱酸式盐的电离和水解.
a)  以HmAn—表示弱酸酸式盐阴离子的电离和水解平衡.
以HmAn—表示弱酸酸式盐阴离子的电离和水解平衡.
Hm+1A(n—1)—+OH— HmAn—1 + H2O Hm—1A(n+1)—+ H+
抑制水解 抑制电离
增大[OH—] 促进电离 促进水离 [H+]增大
仅能存在于一定pH值范围
③常见酸式盐溶液的酸碱性
碱性:NaHCO3、NaHS、Na2HPO4、NaHS. 酸性:NaHSO3、NaH2PO4、NaHSO4
(三)影响水解的因素
内因:盐的本性.
外因:浓度、湿度、溶液碱性的变化
(1)温度不变,浓度越小,水解程度越大.
(2)浓度不变,湿度越高,水解程度 越大.
(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的影响.
![]() HA H++A——Q A—+H2O HA+OH——Q
HA H++A——Q A—+H2O HA+OH——Q
温度(T)T↑→α↑ T↑→h↑
加水 平衡正移,α↑ 促进水解,h↑
增大[H+] 抑制电离,α↑ 促进水解,h↑
增大[OH—]促进电离,α↑ 抑制水解,h↑
增大[A—] 抑制电离,α↑ 水解程度,h↑
注:α—电离程度 h—水解程度
思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?
②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸,对CH3COOH电离程度 和CH3COO—水解程度各有何影响?
(五)盐类水解原理的应用
1.判断或解释盐溶液的酸碱性
例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分别为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________
②相同条件下,测得①NaHCO3 ②CH3COONa ③NaAlO2三种溶液的pH值相同。那实验么它们的物质的量浓度由大到小的顺序是_______________.
因为电离程度CH3COOH>HAlO2所以水解程度NaAlO2>NaHCO3>CH3COON2在相同条件下,要使三种溶液pH值相同,只有浓度②>①>③
2.分析盐溶液中微粒种类.
例如 Na 2S和NaHS溶液溶液含有的微粒种类相同,它们是Na+、S2—、HS—、H2S、OH—、H+、H2O,但微粒浓度大小关系不同.
3.比较盐溶液中离子浓度间的大小关系.
(1)一种盐溶液中各种离子浓度相对大小
①当盐中阴、阳离子等价时
[不水解离子] >[水解的离子] >[水解后呈某性的离子(如H+或OH—)] >[显性对应离子如OH—或H+]
实例:aCH3COONa. bNH4Cl
a.[Na+]>[CH3COO—] >[OH—] >[H+] b.[Cl—] >[NH4+]>[OH—]
②当盐中阴、阳离子不等价时。
要考虑是否水解,水解分几步,如多元弱酸根的水解,则是“几价分几步,为主第一步”,实例Na2S水解分二步
![]() S2—+H2O HS—+OH—(主要)
S2—+H2O HS—+OH—(主要)
HS—+H2O H2S+OH—(次要)
各种离子浓度大小顺序为:
[Na+]>[S2—] >[OH—] >[HS—] >[H+]
(2)两种电解质溶液混合后各种离子浓度的相对大小.
①若酸与碱恰好****以应,则相当于一种盐溶液.
②若酸与碱反应后尚有弱酸或弱碱剩余,则一般弱电解质的电离程度>盐的水解程度.
4.溶液中各种微粒浓度之间的关系
以Na2S水溶液为例来研究
(1)写出溶液中的各种微粒
阳离子:Na+、H+ 阴离子:S2—、HS—、OH—
(2)利用守恒原理列出相关方程.
10电荷守恒:[Na+]+[H+]=2[S2—]+[HS—]+[OH—]
20物料守恒: Na2S=2Na++S2—
若S2—已发生部分水解,S原子以三种微粒存在于溶液中。[S2—]、[HS—],根据S原子守恒及Na+的关系可得.
[Na+]=2[S2—]+2[HS—]+2[H2S]
30质子守恒
![]() H2O H++OH—
H2O H++OH—
由H2O电离出的[H+]=[OH—],水电离出的H+部分被S2—结合成为HS—、H2S,根据H+(质子)守恒,可得方程:
[OH—]=[H+]+[HS—]+2[H2S]
小结:溶液中的几个守恒关系
(1)电荷守恒:电解质溶液呈电中性,即所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数代数和为零。
(2)物料守恒(原子守恒):即某种原子在变化过程(水解、电离)中数目不变。
(3)质子守恒:即在纯水中加入电解质,最后溶液中[H+]与其它微粒浓度之间的关系式(由电荷守恒及质子守恒推出)
练一练!写出0.1mol/L Na2CO3溶液中微粒向后三天守恒关系式。
参考答案:
![]() ①[Na+]+[H+]=[OH—]+[HCO3—]+2[CO32—]
①[Na+]+[H+]=[OH—]+[HCO3—]+2[CO32—]
②[HCO3—]+[CO32—]+[H2CO3]=0.1
③[OH—]=[H+]+[HCO3—]+2[H2CO3]
5.判断加热浓缩至盐干溶液能否得到同溶质固体。
![]() 例1.AlCl3+3H2O Al(OH)3+HCl △H>0(吸热)
例1.AlCl3+3H2O Al(OH)3+HCl △H>0(吸热)
①升温,平衡右移
![]() ②升温,促成HCl挥发,使水解****
②升温,促成HCl挥发,使水解****
AlCl3+3H2O Al(OH)3+3HCl↑
↓灼烧
Al2O3
![]() 例2.Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4 △H>0(吸热)
例2.Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4 △H>0(吸热)
①升温,平衡右移
②H2SO4难挥发,随C(H2SO4)增大,将抑制水解
综合①②结果,最后得到Al2SO4
从例1例2可小结出,加热浓缩或蒸干盐溶液,是否得到同溶质固体,由对应酸的挥发性而定.
结论:
①弱碱易挥发性酸盐 ![]() 氢氧化物固体(除铵盐)
氢氧化物固体(除铵盐)
② 弱碱难挥发性酸盐![]() 同溶质固体
同溶质固体