化学试卷
可能用到的相对原子质量 H: 1 C:12 O:16 I : 127
第Ⅰ部分 选择题(共48分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
1、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
2、下列说法正确的是( )、
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应在恰当条件下才能实现
C.自发反应一定是熵增大,非自发反应一定是熵减小或不变
D.自发反应在任何条件下都能实现
3、“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快
C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快
D.活化分子之间的碰撞一定是有效碰撞
4、 已达电离平衡的0.1mol/L的醋酸溶液中,为提高醋酸的电离程度,同时使溶液的pH值降低,应采取的措施是( )
A. 加一定量水 B.加热
C. 加入盐酸 D. 加入冰醋酸
5、按下列实验方法能够达到要求的是 ( )
A. 用10mL量筒量取7.50mL稀盐酸
B. 用托盘天平称量出25.20g NaCl晶体
C. 用pH试纸测得某碱溶液的pH为12.7
D. 用25mL碱式滴定管量出14.08mL NaOH溶液
6、 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是( )

A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
7、下列溶液一定呈碱性的是( )
A.pH=8的某电解质溶液 B.c(OH-)>1×10-7mol/L
C.溶液中含有OH- D.溶液中c(OH-)>c(H+)
8、在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已经达到平衡状态:( )
C(g)+D(g)已经达到平衡状态:( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值
⑦混合气体总质量 ⑧混合气体总体积
A.①②③④⑤⑥⑦⑧ B.①③④⑤
C.①②③④⑤⑦ D.①③④⑤⑧
9、下列各选项所述的两个量中,前者一定小于后者的是( )
A.纯水在25℃和100℃时的pH
B.相同温度10mL0.1mol•L-1的盐酸溶液与10mL 0.1mol•L-1的醋酸溶液水电离出的c(H+)
C.![]() 溶液分别中和pH、体积均相同的醋酸和盐酸,消耗
溶液分别中和pH、体积均相同的醋酸和盐酸,消耗![]() 溶液的体积
溶液的体积
D.相同温度下![]() 溶液中的电离平衡常数
溶液中的电离平衡常数
10、下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)===CO2(g) △H1 C(s)+1/2O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+1/2O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O (l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.① &am, p;am, p;nb, sp; B.④ C.②③④ D.①②③
11、250C时,某溶液中由水电离出的c(OH—)=1×10—13 mol/L,该溶液中一定不能大量共存的离子组是( )
A. NH4+ 、Fe3+ 、SO42— 、Cl— B. CO32— 、SO42— 、K+ 、Na+
C. Na+ 、SO42— 、NO3— 、Cl— D. SO42—、 Na+ 、 HCO3— 、K+
12、已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=— 1025KJ/mol。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
4NO(g)+6H2O(g);△H=— 1025KJ/mol。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
 13、如下图所示,不同温度和压强下,在容积不变的密闭容器中对可逆反应:
13、如下图所示,不同温度和压强下,在容积不变的密闭容器中对可逆反应:
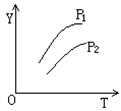 4L(g)
4L(g)![]() 2M(g)+N(g) △H>0平衡状态的影响(P1>P2),图中Y轴是指( )
2M(g)+N(g) △H>0平衡状态的影响(P1>P2),图中Y轴是指( )
A.气体混合物的平均相对分子质量
B.气体混合物的总物质的量浓度
C.L在气体混合物中的体积分数
D.气体混合物的密度
14、将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应 2A(g)+B(g)=2C(g),若经2s (秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是( )
A.①③ B. ①④ C. ②③ D. ③④
15、 在室温下,下列叙述正确的是( )
A.将1mL 1.0×10-5mol/L盐酸稀释到1000mL,得到pH=8的盐酸
B.pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42—)
C.分别用pH=13的NaOH溶液和氨水中和1mL pH=1的盐酸,消耗氨水的体积更大
D.将1mL pH=3的一元酸溶液稀释到10mL,若溶液的pH < 4,则此酸为弱酸
16. 同温同压下,当反应物分解了8%时,总体积也增加8%的是( )
A.2NH3(g) ![]() N2(g)+3H2(g) B.2NO(g)
N2(g)+3H2(g) B.2NO(g) ![]() N2(g)+O2(g)
N2(g)+O2(g)
C.2N2O3(g) ![]() 4NO(g)+O2(g) D.2NO2(g)
4NO(g)+O2(g) D.2NO2(g) ![]() 2NO(g)+O2(g)
2NO(g)+O2(g)