7.(2013大纲卷)五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族、B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径****的是_________________,非金属性最强的是______(填元素符号) 。
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为__________,其中存在的化学键类型为____________________。
(4)D****价氧化物的水化物的化学式为_______________________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为_______________ _______________;D在不充足的E中燃烧,生成的主要产物的化学式为________。
(6)单质E与水反应的离子方程式为_________________________________。
【答案】(1)Na Cl (2)PH3
(3)NH4Cl 离子键和共价键
(4)H3PO4
(5)2P+5Cl2点燃2PCl5 PCl3
(6)Cl2+H2O===H++Cl-+HClO
【解析】由A与B、D、E三种元素均能形成共价化合物,可知该四种元素均为非金属元素,结合A和B形成化合物水溶液显碱性,可知A为H,B为N,则C为Na,D为P;又因为C和E形成的化合物呈中性,可知E为Cl。
题组三 化学键和物质类别
8.下列叙述中,不正确的是( )
A.只有非金属原子间才能形成共价键
B.共价化合物中不可能含有离子键
C.单质中不可能含有离子键
D.非金属单质中可以不含有共价键
【答案】A
【解析】A项,Al与Cl也能形成共价键;B项,含有离子键的化合物一定是离子化合物;C项,含有离子键的物质不可能是单质;D项,稀有气体不含共价键。
9.下列关于化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合物
【答案】A
【解析】离子化合物中一定含有离子键,A项正确;H2、O2等单质分子中均存在共价键,B项错误;CO2分子中含有极性键,但CO2分子属于非极性分子,C项错误;某些离子化合物(如NaOH)中也含有共价键,D项错误。
题组四 化学用语
10.(2014江苏卷)下列关于化学用语的表示正确的是( )
A.过氧化钠的电子式:Na∶··∶O∶Na
B.质子数为35、中子数为45的溴原子:35Br
C.硫离子的结构示意图:![]()
D.间二甲苯的结构简式:![]()
【答案】B
【解析】过氧化钠是离子化合物,电子式为Na+[∶·· ∶·· ∶]2-Na+,A不正确;在表示原子时元素符号在左下角表示质子数,左上角表示质量数,因为质子数和中子数之和是质量数,因此质子数为35、中子数为45的溴原子可表示为35Br,B正确;硫离子的结构示意图为![]() ,C不正确;
,C不正确;![]() 是对二甲苯,间二甲苯的结构简式为
是对二甲苯,间二甲苯的结构简式为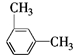 ,D不正确。
,D不正确。
11.下列有关化学用语表示正确的是( )
![]() B.F-的结构示意图:
B.F-的结构示意图:
C.中子数为20 的氯原子: 17Cl
D.NH3 的电子式:![]()
【答案】B
【解析】A项,乙酸的结构简式为CH3COOH;C项,中子数为20的氯原子应表示为 17Cl;D项,NH3的电子式为![]() 。
。