7.(2013年莆田市3月教学质检)为了探索外界条件对反应aX(g)+bY(g)cZ(g)的影响,以X和Y物质的量比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。以下判断正确的是 ( )

A.ΔH>0,a+b>c B.ΔH>0,a+b<c
C.ΔH<0,a+b>c D.ΔH<0,a+b<c
解析:根据图像知,升高温度平衡时Z的物质的量分数减小,说明正反应是一个放热反应,即ΔH<0;增大压强,平衡时Z的物质的量分数增大,说明正反应是一个气体分子数减小的反应,即a+b>c,C项正确。
答案:C
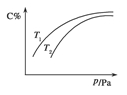
8.(2012年马鞍山市高三质检)在密闭容器中,对于可逆反应A(?)+3B(?)2C(g) ΔH<0,平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是 ( )
A.当n(A)∶n(B)∶n(c)=1∶3∶2时,反应达到平衡状态
B.A、B聚集状态均无法确定
C.压强增大时,混合气体的平均相对分子质量增大
D.其他条件不变,升高温度,反应的平衡常数增大
解析:由该条件不能确定是否达平衡,A项错误;由图知加压C%增加,表明加压平衡向右移动,根据平衡移动原理知正向是气体体积缩小的方向,则B一定是气体,A不确定,此时混合气体的总质量增加或不变,总物质的量在减小,则混合气体的平均相对分子质量增大,B项错误,C项正确;其他条件不变,升高温度,平衡逆向移动,反应的平衡常数减小,D项错误。
答案:C
9.在一定条件下,N2+3H22NH3达到平衡状态后,按如下操作,化学平衡不发生移动的是 ( )
A.保持T、V不变,充入HCl B.保持T、V不变,充入N2
C.保持T、p不变,充入He D.保持T、V不变,充入He
解析:保持T、V不变,充入HCl,HCl与NH3反应生成NH4Cl,平衡向正反应方向移动,A项错误;充入N2,反应物浓度增大,平衡向正反应方向移动,B项错误;保持T、p不变,充入He,各物质的浓度减小,平衡向逆反应方向移动,C项错误;充入He,各物质的浓度不变,平衡不移动,D项正确。
答案:D
10.(2012年北京西城测试)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)2NH3(g)+CO2(g),在不同温度下,该反应平衡状态时的部分数据见下表。下列说法正确的是 ( )
|
温度 |
平衡浓度/(mol·L-1) | |
|
c(NH3) |
c(CO2) | |
|
T1 |
0.1 |
|
|
T2 |
0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
解析:观察表中数据可知,T1时CO2的平衡浓度是0.05 mol·L-1,T2时CO2的平衡浓度是0.1 mol·L-1。A项,若T2>T1,则升高温度,CO2的浓度增大,平衡正向移动,该反应的ΔH>0;B项,向容积恒定的容器中充入N2,平衡不移动,H2NCOONH4质量不变;C项,反应中NH3的体积分数是恒定不变的,故NH3体积分数不变时,不能说明该反应已达到平衡状态;D项,由CO2的平衡浓度可知,T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1),正确。
答案:D
11.(2013年安徽江南十校)下图表示反应X(g)+4Y(g)5Z(g) ΔH<0,在某温度时X的浓度随时间变化的曲线:
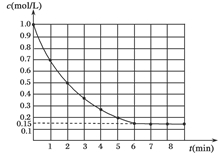
下列有关该反应的描述正确的是 ( )
A.若Z是有色气体,只压缩容器的体积,平衡不移动,则气体颜色不变
B.若升高温度,则X的平衡转化率减小,v(逆)增大,v(正)减小
C.若X和Y的平衡转化率相等,则起始时X和Y的物质的量之比为1∶4
D.若平衡时X的转化率为85%,则起始时Y的物质的量浓度为3.4 mol/L
解析:本题考查了化学反应速率和化学平衡的相关知识。A项,该反应前后气体体积不变,压缩体积,平衡不移动,但气体浓度变大,颜色加深;B项,升高温度时,正、逆反应速率均增大;C项,当X和Y按化学计量数之比投料时,平衡时二者的转化率相等;D项,平衡时,由X的转化率为85%可知Y的转化浓度为3.4 mol/L,则起始时Y的浓度必大于3.4 mol/L,故本题应选C。
答案:C
12.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1]:
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1 mol N2、 3 mol H2 |
2 mol NH3 |
4 mol NH3 |
|
NH3的浓度 (mol·L-1) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是 ( )
A.2c1>c3 B.a+b=92.4
C.2p2<p3 D.α1+α3>1
解析:甲、乙达到的平衡是等效平衡,所以a+b=92.4,α1+α2=1,α3<α2故α1+α3<1,丙可以看作是2个乙分别达到化学平衡后又加压形成的,由于加压后平衡向气体体积减小的方向移动,所以2c1<c3,2p2>p3,A、C、D错。
答案:B