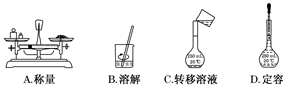
3.(2013·江苏高考)用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
4.(2014·四川高考)设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3△2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
5.在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液浓度偏高的是( )
A.用量筒量取浓盐酸时仰视读数
B.溶解搅拌时有液体飞溅
C.定容时仰视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
6.(2014·上海高考)含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中****分解成单质砷和氢气,若砷的质量为1.50 mg,则( )
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mg
D.转移的电子总数为6×10-5NA
三、非选择题(本题包括3小题,共36分)
7.(12分)将含有2.05 g某高价含氧酸的钙盐的溶液A与含1.20 g碳酸盐的溶液B混合,恰好****反应,生成1.25 g白色沉淀C。将滤去沉淀C的滤液蒸发,得到白色固体D,继续加热D时,D分解只得两种气态物质的混合物,在0 ℃、1×105 Pa下,体积变为0.56 L,并得到0.90 g液态水,另一种气态物质为气态氧化物R2O。
试回答下列问题:
(1)白色沉淀C的物质的量为________mol。
(2)A的摩尔质量为______________,B的摩尔质量为__________。
(3)R2O与H2O的物质的量之比为____________,生成D的质量为__________________,D的摩尔质量为__________,R2O的相对分子质量为____________,R2O的化学式是____________。
(4)写出A和B混合的化学方程式:
________________________________________________________________________。
8.(12分)(2014·长沙模拟)重铬酸钾(K2Cr2O7)是较强的氧化剂,在酸性条件容易被还原成Cr3+,常用于铁矿石(主要成分为FeO和Fe2O3)中铁含量的测定。
(1)称取一定质量的K2Cr2O7配制成500 mL标准溶液,在配制过程中使用的玻璃仪器,除烧杯和玻璃棒外,还需要____________________、______________________________。
(2)在定容时,视线应该____________,直至___________________________________。
(3)请配平滴定原理的化学方程式:______Cr2O7+________Fe2++________H+===________Fe3++________Cr3++________H2O
(4)在配制铁矿石待测液时要向其中滴加适量的SnCl2溶液,其目的是________________________________________________________________________;
若配制K2Cr2O7标准溶液定容时,俯视容量瓶的刻度线,则最终测得铁的含量________(填“偏高”、“偏低”或“无影响”)。
3.解析:选B 本题考查一定物质的量浓度溶液的配制,意在考查考生的化学实验基本操作能力。用托盘天平称量物体的质量时,应“左物右码”,A错误;转移溶液时应使用玻璃棒引流,C错误;定容时胶头滴管不能插入容量瓶内部,D错误。 4.解析:选D A项,铁在高温下与水蒸气反应的化学方程式为3Fe+4H2O(g)高温Fe3O4+4H2,0.2 mol Fe生成H2的分子数约为0.27NA,该项错误;B项,该NaOH溶液中OH-总共有0.1NA,但OH-主要来自于NaOH电离,水电离出很少的OH-,该项错误;C项,氢氧燃料电池正极上反应的物质为O2,当消耗标准状况下22.4 L O2时,转移的电子数为4NA,该项错误;D项,根据化学方程式可知,反应中只有N元素化合价发生改变,生成的8 mol氮原子(4 mol N2)中有5 mol来自NH4,有3 mol来自NO3,故反应中转移电子15 mol,则生成28 g (1 mol) N2时,转移电子数为3.75NA,该项正确。 5.解析:选A A项,用量筒量取浓盐酸时仰视读数使得所取浓盐酸多了,导致所配溶液浓度偏高;B项,搅拌时有液体飞溅,说明有盐酸损失,导致浓度偏低;C项,定容时仰视容量瓶刻度线,说明定容时加水偏多,导致浓度偏低;D项,定容后再加水,加水偏多,导致浓度偏低。 6.解析:选C As2O3+Zn+HCl~AsH3,砒霜作氧化剂,被还原,A项错误;n(As)=2×10-5mol,2AsH3===2As+3H2,n(H2)=3×10-5 mol,标准状况下V(H2)=0.672 mL,B项没有限定标准状况,B项错误;根据氧化还原反应化合价升降相等,3Zn~AsH3,n(Zn)= 6× 10-5 mol,m(Zn)=n(Zn)×M(Zn)=6×10-5 mol×65 g·mol-1=3.9 mg,C项正确;根据氧化还原反应转移电子守恒,n(e-)=1.2×10-4 mol,电子数为1.2×10-4 NA,D项错误。 7.解析:由A+B===C+D知,C为CaCO3,D是一种含三种元素的含氧酸盐,该盐只能是NH4NO3,分解生成的R2O为N2O。A为Ca(NO3)2,B为(NH4)2CO3。 (1)C的物质的量为1.25 g÷100 g·mol-1=0.012 5 mol。 (2)A、B的摩尔质量分别为164 g·mol-1和96 g·mol-1。 (3)N2O的物质的量为0.56 L÷22.4 L·mol-1=0.025 mol, N2O与H2O的物质的量之比为1∶2。 答案:(1)0.012 5 (2)164 g·mol-1 96 g·mol-1 (3)1∶2 2 g 80 g·mol-1 44 N2O (4)Ca(NO3)2+(NH4)2CO3===CaCO3↓+2NH4NO3 8.解析:(1)用K2Cr2O7固体配制500 mL标准溶液,需使用的玻璃仪器,除烧杯和玻璃棒外,还需要500 mL容量瓶、胶头滴管。(2)定容时视线应注视凹液面的最低处与刻度线,直到溶液的凹液面最低处与刻度线相平为止。(3)根据化合价升降总是相等,利用最小公倍数法及电荷守恒即可配平。(4)铁矿石的主要成分为FeO和Fe2O3,在用K2Cr2O7溶液滴定前需把Fe3+还原为Fe2+,向铁矿石待测液中加适量的SnCl2溶液,无疑是将Fe3+还原为Fe2+。配制K2Cr2O7溶液时,俯视容量瓶的刻度线,会导致溶液的体积偏小,溶液的浓度偏大,所测铁的含量偏低。 答案:(1)500 mL容量瓶 胶头滴管 (2)注视凹液面的最低处与刻度线 凹液面的最低处与刻度线相平 (3)1 6 14 6 2 7 (4)将矿石中的Fe3+还原为Fe2+ 偏低