11.(2012年东城区高三期末教学统一检测)下列实验的前后,铜的质量一定发生变化的是 ( )
A.铜丝在空气中灼烧后立即插入乙醇
B.铜片放入酸化的硝酸钠溶液
C.铜和铁的混合物放入稀硝酸
D.铜、锌、稀硫酸构成的原电池放电
解析:A项,铜丝在空气中灼烧后立即插入乙醇,铜是乙醇催化氧化的催化剂,铜丝在反应前后质量不变;B项相当于有硝酸存在,铜片能溶解,其质量减小;C项,铁比铜活泼,铁一定溶解,但铜不一定溶解,即其质量不一定减小;D项,铜和锌分别作正极和负极,锌溶解,而铜不溶解,故铜的质量不变。
答案:B
12.(2013届山西省高三四校联考Ⅰ)氧化铜和氧化铁的混合物a g,加入2 mol·L-1的硫酸溶液50 mL,恰好****溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为 ( )
A.
C.(a-3.2) g D.无法计算
解析:由守恒关系得:n(O)=n(SO)=2 mol·L-1×
答案:B
二、非选择题(本题包括4小题,共52分)
13.(8分)我国古代劳动人民最早发明了“湿法炼铜”,是湿法冶金的起源,在世界化学****是一项重大贡献,早在西汉时期《淮南万毕术》里就有“曾青得铁,则化为铜”的记载,曾青可能是碳酸铜一类物质,把其溶于酸中得溶液,当把铁粉投入此溶液即可得铜。
(1)根据学过的化学知识,写出该过程的离子方程式:
____________________________________________________________。
(2)早在人们使用铜、铁之前,人们就使用黄金和白银作为饰物和货币;历****的“青铜器时期”早于“铁器时期”,而近百年来才大量使用铝制品,试分析人类使用这些金属时间的历史事实与金属活泼性的冶炼难易的联系:
____________________________________________________________。
解析:(1)碳酸铜难溶于水但溶于酸发生反应:CuCO3+2H+===Cu2++CO2↑+H2O,再加入铁粉可发生置换反应:Fe+Cu2+===Fe2++Cu。
(2)由题意可知,人类使用金属从早到晚的顺序为Au、Ag、Cu、Fe、Al,比较它们的活泼性可得如下结论:金属越不活泼越易冶炼,使用的时间越早。
答案:(1)CuCO3+2H+===Cu2++CO2↑+H2O,Cu2++Fe===Cu+Fe2+
(2)金属越不活泼越易冶炼使用时间越早
14.(14分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点
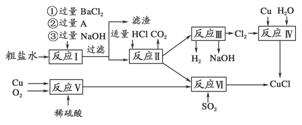
(1)A的化学式为_____________________________________________。
(2)写出反应Ⅴ的化学方程式_____________________________________。
(3)写出反应Ⅵ的离子方程式____________________________________。
(4)本工艺中可以循环利用的物质是(化学式表示)
___________________________________________________________。
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于
解析:制备过程会涉及到分离提纯的实验,要注意结合流程综合考虑。为了使杂质尽量除尽,一般加入的除杂试剂需要过量,过量的除杂试剂在后边的操作中被除去。
答案:(1)Na2CO3
(2)2Cu+O2+2H2SO4===2CuSO4+2H2O
(3)2Cu2++2Cl-+SO2+2H2O===2CuCl↓+4H++SO
(4)NaOH、H2SO4
(5)加快乙醇和水的蒸发,防止CuCl被空气氧化
15.(14分)(2013年马鞍山市一模)某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究,请完成下列探究报告。
【探究目的】探究该焰火原料的成分
【资料检索】
(1)Mg2+检验方法:取2滴待测液,加入2滴2 mol·L-1 NaOH溶液,再加入2滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待测液中含有Mg2+。(注:Ag+、Cu2+、Fe3+、NH会妨碍Mg2+的检测)
(2)Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液。
【实验探究】
(1)甲同学进行了初步实验,实验步骤和实验现象如下,请填写下表:
|
实验 |
|||
|
序号 |
实验步骤 |
实验现象 |
结论 |
|
① |
取少量该焰火原料,加入冷水 |
无明显现象 |
________ |
|
② |
取少量该焰火原料,加入足量稀盐酸 |
****溶解,有大量气体产生、溶液呈无色 |
________ |
(2)乙同学取甲同学第②组实验所得的溶液,加入2滴NaOH溶液及镁试剂(Ⅰ)染料,未见天蓝色物质。他得出合金中不含镁的结论,乙同学的结论________(填“正确”或“错误”),你的理由是____________________。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下:
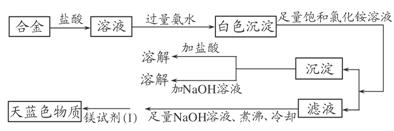
由丙同学的实验记录可知该焰火原料是由________和________两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸的理由是______________________。
解析:(1)①原料加入冷水无现象表明不含Li、Na等活泼金属。②原料与盐酸反应产生气体表明含有能与盐酸反应的较活泼的金属。(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀,从而不能吸附镁试剂(Ⅰ)染料呈天蓝色,所以错误。(3)由图结合题意知该合金含镁、铝(不溶于足量饱和氯化铵溶液的白色沉淀既能溶于盐酸又能溶于氢氧化钠);由于Mg(OH)2可溶于浓的氯化铵溶液,因此用镁试剂(Ⅰ)染料检验Mg2+时要排除NH的干扰,所以滤液加入足量氢氧化钠溶液将NH转化为NH3,煮沸将氨气赶出。
答案:(1)①合金中不含Li、Na等活泼金属 ②含有能与盐酸反应的较活泼的金属
(2)错误,若稀盐酸过量,则不产生沉淀,就不能吸附镁试剂(Ⅰ)染料,检验不出Mg2+
(3)Mg Al 将NH转化为NH3,煮沸促进氨气逸出,防止NH干扰Mg2+的检验(或排除溶液中NH的干扰)
16.(16分)(2012年江西省丰、樟、高、宜四市高三联考)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
【查阅资料】
Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。
假设2:红色粉末是Cu2O。
假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是__________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________,简述你的理由(不需写出反应的方程式):_________________________________________________________。
(3)若固体粉末****溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是________。
【探究延伸】
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为____________________。
解析:(1)若红色粉末为Fe2O3,则加入足量稀硫酸后固体****溶解,在所得的溶液中再滴加KSCN试剂,溶液呈红色。(3)若固体粉末****溶解无固体存在,滴加KSCN试剂后,溶液不变红色,说明溶液中没有Fe3+,即全部与Cu反应生成Fe2+,所以原固体粉末为Fe2O3和Cu2O的混合物。(4)2Cu2O+O24CuO,固体增加的质量就是参与反应的氧气的质量。可得关系式:=,故m(Cu2O)=9(b-a) g,混合物中Cu2O的质量分数为×100%。
答案:(1)固体****溶解,溶液呈红色
(2)不合理 当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀硫酸后产生的Fe3+全部与Cu反应生成Fe2+,滴加KSCN溶液后也不变红色
(3)Fe2O3和Cu2O
(4)×100%[或×100%]