26. (4分)根据题意填写下列空格:
(1)c mol·L-1 KCl溶液的密度为ρg/cm3,则此KCl溶液的质量分数为 ▲ ;
(2)标准状况下,将充满NO2的试管倒立于盛有蒸馏水的水槽中,足够长时间后,假设不考虑溶质扩散,试管中溶质的物质的量浓度为 ▲ mol·L-1。
27.(10分) 已知C与Sn在元素周期表中处于同一主族。回答下列问题:
(1)配平: ▲ Na2CO3+ ▲ SnO2+ ▲ S![]() ▲ Na2SO4 + ▲ Na2SnS3+ ▲ CO2↑。
▲ Na2SO4 + ▲ Na2SnS3+ ▲ CO2↑。
(2)上述反应中氧化剂与还原剂的物质的量之比是 ▲ 。标准状况下,若产生
(3)上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是
▲ (选填编号)。
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素****价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
(4)常温下,测得Na2SnS3溶液pH>7,请用离子方程式表示其原因: ▲ 。
28. (6分)硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
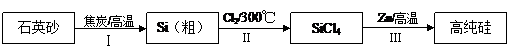
(1)硅元素位于元素周期表的第__▲__周期__▲____族。
(2)已知反应Ⅰ得到的粗硅中含有SiC,其中Si和SiC的物质的量之比为2∶1。写出制造粗硅时的反应方程式 ▲ 。SiC熔融时不导电,工业上常用作耐火和高温炉的材料,由此推知,它属于____▲_____晶体。
(3)因为SiCl4遇水剧烈水解生成SiO2和一种酸,所以整个制备过程必须严格控制无水条件。在干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约
29.(8分) W、X、Y、Z、T均是短周期元素,W和X同周期,W和Y同主族;W原子最外层电子数是内层电子数的两倍,X元素族序数是所在周期数的三倍;X的阴离子与Z的阳离子的电子层结构相同;Z的单质与X的单质在不同条件下反应,可生成Z2X或Z2X2;T和Z同周期,且T是所在周期中原子半径最小的元素。请回答:
(1)WX2的结构式是 ▲ 。
(2)X、Z、T离子半径由大到小的顺序为 ▲ (用离子符号回答)。
(3)X、T的气态氢化物沸点较高的是 ▲ (用化学式回答),原因是 ▲ 。
(4)水中锰含量超标,容易使洁具和衣物染色,TX2可以用来除去水中超标的Mn2+,生成黑色沉淀。当消耗
三、实验题:(本大题包括1小题,共12分)
30.碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的流程如下:
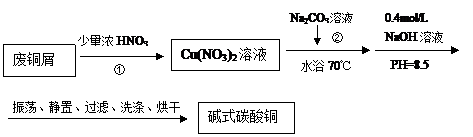
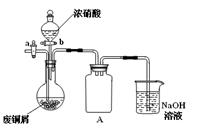
(1)步骤①在右图装置中进行。浓硝酸与铜反应的离子方程式 ▲ 。
(2)已知:NO+NO2+2NaOH 2NaNO2+H2O;2NO2+2NaOH NaNO3+NaNO2+H2O,NO不能单独与NaOH溶液反应,实验结束时,如何操作才能使该装置中的有毒气体被NaOH溶液充分吸收? ▲ 。
(3)步骤②中,水浴加热所需仪器有 ▲ 、 ▲ (加热、夹持仪器、石棉网除外);洗涤的目的是 ▲ 。
(4)步骤②的滤液中可能含有CO32-,检验CO32-存在的方法 ▲ 。
(5)若实验得到
四、计算题:(本大题包括1小题,共10分)
31. 在200mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,见下图一所示。
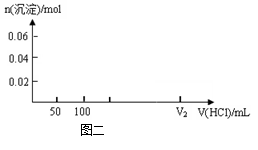
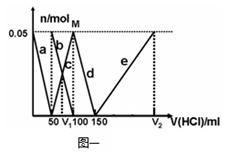
(1)原混合溶液中Na2CO3的物质的量, 浓度为 ▲ mol·L-1
(2)V1: V2= ▲ 。
(3)若滴加盐酸过程中得到沉淀
(4)在上图二坐标中画出该混合溶液中逐滴加入1mol·L-1的盐酸,所得沉淀的物质的量与加入盐酸溶液的体积变化关系。
26.(4分)(每空2分) (1) (2)1/22.4 (或0.045) mol·L-1 27.(10分)每空2分 (1) 2 Na2CO3+ 1 SnO2+ 4 S (2)3:1; 3 (3)b d (4)SnS32-+H2O 28.(6分) (1)三、ⅣA (共1分。只要有一处错误,均不给分) (2)3SiO2+ (3)使水蒸气冷凝,减少进入浓硫酸的水,使浓硫酸能保持持续的吸水性(1分),同时降低放出的热量(1分)。 29.(8分) (1)O=C=O(2分); (2)r(Cl-)>r(O2-)>r(Na+) (2分。顺序****正确才给分,有一项错不给分) (3)H2O;水分子间存在氢键 (每空1分,共2分) (4)2ClO2+5Mn2++6H2O===5MnO2+2Cl- +12H+ (2分) 三、实验题:(本大题包括1小题,共12分) 30. (12分) (1)Cu+4H++2NO3-===Cu2++2NO2↑+2H2O (2分。配平错误扣1分) (2)关闭活塞b ,打开活塞a,通入一段时间空气(2分) (3)烧杯、温度计(各1分,共2分) ; 除去产品表面吸附的Na+和NO3-(2分) (4)取少量滤液于试管中,加入稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明有CO32-(2分) 四、计算题:(本大题包括1小题,共10分) 31.(10分) (1)0.25 mol·L-1(2分) (2)1:4 (2分) (3)12.5mL 或262.5mL(4分) (4)作图( 2分)![]() 1Na2SO4 + 1 Na2SnS3+ 2 CO2↑
1Na2SO4 + 1 Na2SnS3+ 2 CO2↑![]() HSnS3-+OH- (不写可逆符号,扣1分;没有分步水解,不得分)
HSnS3-+OH- (不写可逆符号,扣1分;没有分步水解,不得分)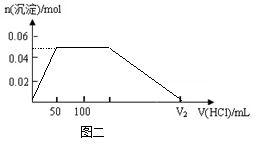 (5)0.917或91.7%或0.92或92%均正确(2分)
(5)0.917或91.7%或0.92或92%均正确(2分)