二、非选择题(本大题共4小题,共58分。按题目要求作答。解答题应写出必要的文字说明、方程式和重要演算步骤,只写出最后答案的不能得分。有数值计算的题,答案必须明确写出数值和单位。)
8.(13分)Ⅰ.烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
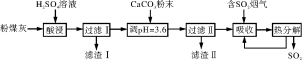
(1)酸浸时反应的化学方程式为:______________;滤渣Ⅰ的主要成分为______(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使溶液中的Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为______(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是_________________________________(用离子方程式表示)。
Ⅱ.(1)已知:
|
化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
|
熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是____________________________;制铝时,电解Al2O3而不电解AlCl3的原因是________。
(2)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是__________。
a.NH3 b.HI c.SO2 d.CO2
(3)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
9.(15分)氧化铁俗称铁红,可用于水泥制件、橡胶制品、塑料制品的着色,在工业上有广泛的用途,某工厂采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备氧化铁,如下图所示。
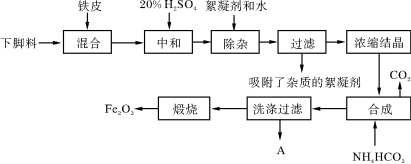
已知煅烧过程中的化学反应方程式为:FeCO3高温FeO+CO2↑,4FeO+O2高温2Fe2O3。
(1)向下脚料废液中加入铁皮的作用是(用有关的离子方程式表示)___________________。
(2)加入20%H2SO4的作用是__________________________________________________。
(3)浓缩结晶后得到的晶体是________________(填化学式), A中所含的离子除H+、OH-、NH4外,还含有大量的______________,检验该离子的方法是_______________________。
(4)写出步骤“合成”中发生的化学变化(用化学方程式表示):______________________。
10.(15分)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其他物质。
(1)提出合理假设。
假设1:该漂白粉未变质,只含__________;
假设2:该漂白粉全部变质,只含__________;
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
(2)设计实验方案,进行实验。
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1 mol·L-1 HCl溶液、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满)
|
实验步骤 |
预期现象和结论 |
|
步骤一:取少量上述漂白粉于试管中,____________________________________ ___________________________________ |
__________________________________ __________________________________ |
|
步骤二:______________________________ ________________________________ |
__________________________________ __________________________________ |
11.(15分)氯化铜可用于生产颜料、木材防腐剂等。用粗铜(含杂质Fe)经过系列步骤可制备氯化铜晶体(CuCl2·2H2O)。完成下列填空:
(1)实验室用浓盐酸和二氧化锰共热来制备Cl2,写出该反应的离子方程式:________________________________。
(2)加入试剂将CuCl2和FeCl3的混合溶液pH调至4~5,过滤得到纯净的CuCl2溶液,应加入的试剂是________(填字母编号)
a.CuO b.NaOH
c.Cu2(OH)2CO3 d.Cu
(3)CuCl2溶液通过蒸发、结晶可得到CuCl2·2H2O。
①蒸发过程中,加入盐酸的目的是_________________________________。
②蒸发过程中,观察到溶液颜色由蓝色变为绿色。
其原理是:[Cu(H2O)4]2+蓝色 (aq)+4Cl-(aq)![]() (CuCl4)2-绿色 (aq)+4H2O(l)
(CuCl4)2-绿色 (aq)+4H2O(l)
上述反应的化学平衡常数表达式是____________________________________。
欲使溶液由绿色变成蓝色的措施是:a____________________;b____________________。
(4)由CuSO4溶液蒸发结晶得到CuSO4·5H2O的过程中不用加入硫酸,其原因是__________________________________________________(用勒夏特列原理解释)。