高一第一学期期中考试化学试题
(时间90分钟 满分100分)
可能用到的相对原子质量:H-1、O-16、C-12、N—14、S-32、Cl-35.5
Na—23、Cu-64、Fe—56、 Ba—137、Mg—24 、Al—27
Ⅰ卷
一、选择题(下列每小题只有1个选项符合题意,每小题2分,共40分)
1.下列反应不属于氧化还原反应的是 ( )
A.2HClO=2HCl+O2↑ B.Zn+CuSO4=Cu+ZnSO4
C.AlCl3+4NaOH=3NaCl+NaAlO2+2H2O D.H2+F2=2HF
2.张青莲是我国著名的化学家,1991年他****测得In的相对原子质量为114.818,被国 际相对原子质量委员会采用为新的标准值。下列关于In的说法中,错误的是( )
A. ![]() In原子核外有49个电子 B.
In原子核外有49个电子 B. ![]() In原子核内有49个中子
In原子核内有49个中子
C. ![]() In原子核内质子数和中子数之和为115 D.
In原子核内质子数和中子数之和为115 D. ![]() In是In元素的一种核素
In是In元素的一种核素
3.下列物质的分类合理的是 ( )
A.酸:HNO3、H2SO4、NaHSO4、NaHCO3
B.碱性氧化物:K2O、Na2O、CaO、MgO
C.胶体:牛奶、豆浆、碘酒、石灰水
D.电解质:MgCl2、Na2CO3、C2H5OH、CO2
4.下列叙述中正确的是 ( )
A.标准状况下,22.4 L H2SO4中含有6.02×1023个硫原子
B.常温常压下,O2和O3的混合物16g中含有6.02×1023个氧原子
C.500mL 0.5mol·L-1的Fe2(SO4)3溶液中SO42-浓度为0.75 mol·L-1
D.0.5mol OH-中含有3.01×1023个电子
5.下列溶液中c(Cl-)与50 mL 1 mol·L-1 AlCl3溶液中c(Cl-)相等的是 ( )
A.150 mL 1 mol·L-1的NaCl溶液 B.75 mL 3 mol·L-1 MgCl2溶液
C.150 mL 2 mol·L-1的KCl溶液 D.75 mL 1 mol·L-1的FeCl3溶液
6.下列各组物质中,前者为强电解质,后者为弱电解质的是 ( )
A.硫酸,硫酸镁 B.碳酸,碳酸钠
C.食盐,酒精 D.碳酸氢钠,醋酸
7.工业上制造镁粉是将镁蒸气在气体中冷却。可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①② B.②③ C.③④ D.④⑤
8.某溶液中含有大量的Cl-、CO32-、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作中,顺序正确的是 ( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ &am, , , p;nb, sp; B.④②①②③
C.①②③②④ D.④②③②①
9.下列各组溶液中离子,能在溶液中大量共存的是 ( )
A.H+、Ca2+、NO3-、CO32- B.K+、Na+、Br-、NO3-
C.Ag+、Na+、Cl-、K+ D.NH4+、K+、OH-、SO42-
10.对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5:1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5:1
11.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应并不改变的是 ( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.木炭和O2
12.下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
13.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称2.4 g NaOH时误用了“左码右物”的方法
14.下列括号中的物质是除去杂质所需的药品,其中错误的是 ( )
A.NaCl中有杂质Na2SO4(氯化钡) B.FeSO4中有杂质CuSO4(铁粉)
C.CO2中有少量HCl气体(氢氧化钠溶液)D.CO2中有少量CO(灼热的氧化铜)
15.下面有关Na2CO3与NaHCO3的性质比较中错误的是 ( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
16.已知 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2 ;2FeCl2 + Cl2 = 2FeCl3 。据此可判断各物质的氧化性由强到弱的顺序是 ( )
A、FeCl3 > Cl2 > I2 B、Cl2 > FeCl3 > I2 C、I2 > Cl2 > FeCl3 D、Cl2 > I2 > FeCl3
17.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是( )
A.![]() L B.
L B.![]() C.
C.![]() L D.
L D.![]() L
L
18.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol·L-1,
SO42-物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度为 ( )
A.0.1 mol·L-1 B.0.15 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
19.如图装置应用于实验室制氯气和有关氯气性质的实验,能达到实验目的是( )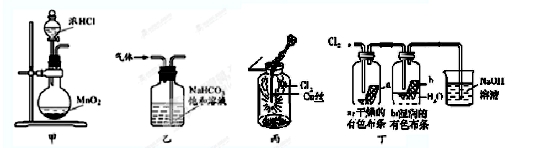
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.装置丙:生成棕色的固体,证明Cl2有强氧化性
D.装置丁:湿润的有色布条褪色,证明Cl2有漂白性
20.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1的盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
