16.(10分)某兴趣小组在实验室模拟反应PCl3+SO2+Cl260~65 ℃POCl3+SOCl2制备重要的化工原料POCl3。
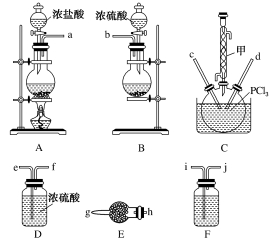
已知:PCl3的熔点为-93.6 ℃,沸点为76.1 ℃,遇水极易水解,易与O2反应;POCl3的熔点为1.25 ℃,沸点为105.8 ℃,遇水强烈水解,能溶于PCl3。
(1)装置A中发生反应的离子方程式是__________________________。
(2)以上各仪器接口的连接顺序是a→________→________→________→________→cd←g←h←b(仪器不重复使用),装置E中的试剂是无水氯化钙,F中所装的试剂是________。
(3)装置C制备POCl3。
①仪器甲的名称是________。
②反应温度控制在60~65 ℃,其原因是__________________________________。
③POCl3发生水解反应生成HCl和________。
(4)该装置不足之处是________________________________________________________________________。
17.(14分)Ⅰ.NH3与NO2是常见的氮的化合物,研究它们的综合利用有重要意义。
(1)NO2产生的环境问题有________(填一种)。
(2)热电厂通常用NH3消除燃煤烟气中的NO2,写出该反应的化学方程式________________________________________________________________________。
(3)氨气与氯化氢气体混合的现象是____________,该反应可用于________________________________________________________________________。
(4)若将少量氨气与过量氯气混合,则生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式______________,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学方程式__________________________。
Ⅱ.向SO2的饱和溶液中加入BaCl2溶液无明显现象,得混合溶液M。
(5)若将下列各物质分别加入溶液M中,均可产生沉淀。其中原理相同、沉淀相同的是________。
a.氨水、NaOH溶液 b.氯水、FeCl3溶液
c.H2S溶液、氯水 d.硫酸、溴水
(6)若向溶液M中加入CaCO3粉末,则产生亚硫酸钡沉淀,请用化学反应原理予以解释(用离子方程式结合必要的文字)________________________________________________________________________
________________________________________________________________________。
18.(10分)A、B、C、D、E、F为中学化学常见的单质或化合物,其中A、F为单质,常温下,E的浓溶液能使铁、铝钝化,转化关系如图所示(条件已略去)。

完成下列问题:
(1)若A为淡黄色固体,B为气体,F为非金属单质。
①写出E转化为C的化学方程式________________________________。
②B在空气中能使银器表面失去金属光泽、逐渐变黑,反应的化学方程式为________________________________________________________________________。
(2)若B为能使湿润的红色石蕊试纸变蓝的气体。
①A的电子式为________。
②做过银镜反应后的试管可用E的稀溶液清洗,反应的离子方程式为________________________________________________________________________。
③在干燥状态下,向②中反应得到的溶质中通入干燥的氯气,得到N2O5和一种气体单质,写出反应的化学方程式________________________________________________________________________。
19.(12分)[2019·河南安阳第三实验中学模拟]某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程,NH3的转化过程如图1所示。

图1
甲、乙两同学分别按如图2所示装置进行实验。用于装置A、B中的可选药品:浓氨水、30%H2O2溶液、蒸馏水、NaOH固体、MnO2。
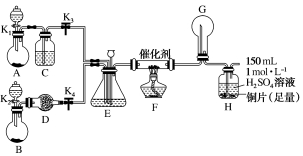
图2
(1)装置A的圆底烧瓶中发生反应的化学方程式为________________。装置E有多种作用,下列关于装置E的作用和其中所盛液体的说法,不正确的是________(填标号)。
a.使氨气和氧气充分混合
b.控制通入氨气和氧气的体积比
c.平衡装置内的压强
d.锥形瓶内液体是饱和食盐水
(2)甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,装置H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为_________________,若制得的氨气仅按Ⅰ→Ⅱ→Ⅲ的顺序****转化为硝酸,欲使装置H中所得溶液为纯净的CuSO4溶液(忽略Cu2+
的水解),理论上所需氨气在标准状况下的体积为________L(假设硝酸与铜反应产生的还原产物全部从反应装置排出)。
(3)乙同学为模拟过程Ⅳ的反应,在甲同学操作的基础上对该装置进行了一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是________(填标号)。
a.关闭K3并熄灭酒精灯
b.关闭K4并熄灭酒精灯
c.关闭K3、K4并熄灭酒精灯
(4)丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷是________________。
20.(14分)[2019·黑龙江铁人中学月考]根据下列反应框图填空。已知反应①是工业上生产化合物D的反应,反应⑤是实验室检验化合物E的反应。
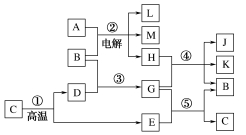
(1)单质L是________;化合物A是________。
(2)图中除反应①外,还有两个用于工业生产的反应,是________和________(填代号)。它们反应的化学方程式分别是____________________________和____________________________________。
(3)E和K、J混合溶液反应的化学方程式为______________________________。此反应的发生说明了
________________________________________________________________________
________________________________________________________________________。
(4)把K、J混合固体放入少量浓盐酸中,则其反应的现象是________________________________________________________________________
________________________________________________________________________。

