一、选择题:本题共7小题,每小题2分,共14分。每小题只有一个选项符合题意。
1.[2020·湖南邵阳二中月考]在水溶液中能大量共存的一组离子是( )
A.Fe3+、Na+、Cl-、SiO3(2-) B.K+、Ba2+、ClO-、S2-
C.K+、Na+、S2-、SO3(2-) D.H+、K+、SO3(2-)、Br-
2.[2019·浙江嘉兴一中期末考试]下列指定反应的离子方程式书写正确的是( )
A.(CH3COO)2Ca与硫酸溶液反应:
Ca2++SO4(2-)===CaSO4↓
B.次氯酸钠溶液吸收少量二氧化硫气体:
SO2+H2O+ClO-===SO4(2-)+Cl-+2H+
C.将过量SO2通入氨水中:
SO2+NH3·H2O===HSO3(-)+NH4(+)
D.电解饱和氯化镁溶液:
2Cl-+2H2O通电(=====)H2↑+Cl2↑+2OH-
3.[2019·甘肃西北师大附中期中]室温下,下列各组离子能大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO4(2-)、NO3(-)
B.NaHS溶液中:SO4(2-)、K+、Cl-、Cu2+
C.c(H+)(KW)=10-13 mol·L-1的溶液中:NH4(+)、Mg2+、SO4(2-)
D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3(-)
4.[2020·湖北武汉市级示范高中联考]下列选项中的两个反应可用同一个离子方程式表示的是( )
|
选项 |
Ⅰ |
Ⅱ |
|
A |
将少量SO2通入Ba(OH)2溶液 |
将过量SO2通入Ba(OH)2溶液 |
|
B |
将少量浓氨水滴入Al2(SO4)3溶液 |
将少量Al2(SO4)3溶液滴入浓氨水 |
|
C |
将0.1 mol Cl2通入含0.2 mol FeBr2的溶液 |
将0.3 mol Cl2通入含0.2 mol FeBr2的溶液 |
|
D |
少量BaCl2溶液与Na2SO4溶液混合 |
少量Ba(OH)2溶液与MgSO4溶液混合 |
5.[2020·安徽江南十校质检]下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是( )
|
选项 |
微粒组 |
加入试剂 |
发生反应的离子方程式 |
|
A |
Ba2+、HCO3(-)、 Cl- |
少量NaOH 溶液 |
HCO3(-)+OH-=== CO3(2-)+H2O |
|
B |
NH4(+)、Fe2+、 Br-、SO4(2-) |
过量H2S |
Fe2++H2S=== FeS↓+2H+ |
|
C |
HClO、Na+、 Fe3+、SO3(2-) |
过量CaCl2 |
Ca2++SO3(2-)=== CaSO3↓ |
|
D |
I-、Cl-、 H+、SO4(2-) |
适量NaNO3 |
6I-+2NO3(-)+8H+=== 2NO↑+4H2O+3I2 |
6.[2020·湖北荆州中学测试]雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4(+)、Mg2+、Al3+、SO4(2-)、NO3(-)、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如图所示的实验。
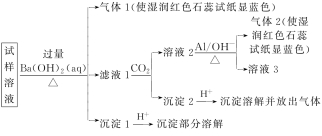
已知:3NO3(-)+8Al+5OH-+2H2O△(=====)3NH3↑+8AlO2(-)。
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4(+)、Mg2+、SO4(2-)和NO3(-)
B.试样中可能存在Na+、Cl-
C.试样中一定不含Al3+
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
7.[2020·四川成都石室中学月考]溶液X中含有下表离子中的某5种,且其浓度均为0.1 mol·L-1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是( )
|
阳离子 |
阴离子 |
|
Na+、Fe3+、Ca2+、Fe2+、Mg2+、Al3+ |
OH-、NO3(-)、HCO3(-)、CO3(2-)、SO4(2-)、Cl- |
A.X溶液中一定含3种阳离子、2种阴离子
B.X溶液中不可能含有HCO3(-)或CO3(2-)
C.生成无色气体的离子方程式为3Fe2++NO3(-)+4H+===3Fe3++NO↑+2H2O
D.根据电荷守恒,原溶液中一定含Mg2+
二、选择题:本题共3小题,每小题4分,共12分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。
8.下列有关叙述和离子方程式都正确的是( )
A.用饱和氯化铁溶液腐蚀铜质电路板:Fe3++Cu===Fe2++Cu2+
B.向FeI2溶液中滴加过量的溴水:3Br2+4I-+2Fe2+===2I2+6Br-+2Fe3+
C.盐酸与NaHSO3溶液反应证明HCl的酸性比H2SO3强:SO3(2-)+2H+===SO2↑+H2O
D.用饱和碳酸钠溶液浸泡水垢,其中CaSO4发生转化:CaSO4+CO3(2-)===CaCO3+SO4(2-)
9.某溶液中可能存在Na+、Al3+、Fe2+、NH4(+)、NO3(-)、CO3(2-)、SO4(2-)中的几种离子,且存在的各离子的物质的量相等,某同学对该溶液进行如下实验:
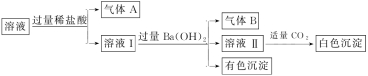
下列判断正确的是( )
A.气体A一定是CO2,气体B一定是NH3
B.白色沉淀不可能是Al(OH)3
C.原溶液中一定存在Al3+、Fe2+、NO3(-)、NH4(+)
D.原溶液中一定不存在Na+
10.某100 mL澄清透明溶液中仅含如表所示离子中的几种(不考虑水的电离与离子的水解),且各离子的物质的量浓度均相等。
|
阳离子 |
Na+、K+、Cu2+、Ba2+、Fe2+、Fe3+ |
|
阴离子 |
CO3(2-)、HCO3(-)、SO4(2-)、OH-、NO3(-)、Cl- |
取该溶液分别进行如下实验:
①向该溶液中加入BaCl2溶液,有白色沉淀生成;
②向该溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变;
③用铂丝蘸取少量该溶液,在火焰上灼烧,透过蓝色钴玻璃片没有观察到紫色火焰。
下列叙述不正确的是( )
A.由实验①判断,原溶液中一定含有SO4(2-)
B.由实验②判断,原溶液中不存在OH-、CO3(2-)、HCO3(-)
C.由实验③判断,原溶液中一定不含有的阳离子是Na+、K+
D.原溶液中含有的离子有Cu2+、Fe2+、SO4(2-)、NO3(-)、Cl-
三、非选择题:本题共3小题。
11.(12分)[2020·山东济南一中月考]元素化合物在化工生产和环境科学中有着重要的用途。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为____________、______________、____________。
(2)自然界中Cr主要以+3价和+6价形式存在。Cr2O7(2-)中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将Cr2O7(2-)还原。写出反应的离子方程式:________________________。
(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。写出该反应的离子方程式:________________________。
(4)已知M2On(2-)可与R2-作用,R2-被氧化为R的单质,M2On(2-)的还原产物中M显+3价,又知c(M2On(2-))=0.3 mol·L-1的溶液100 mL可与c(R2-)=0.6 mol·L-1的溶液150 mL恰好****反应,则n等于________。
12.(12分)[2020·山东恒台一中诊断]钴被誉为战略物资,有****的性能和广泛的应用。用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取钴产品的工艺流程如下:
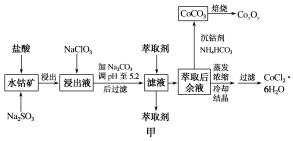
已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
|
开始 沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
|
**** 沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
回答下列问题:
(1)写出浸出过程Co2O3发生反应的离子方程式:__________________________________。
(2)写出NaClO3发生主要反应的离子方程式:________________________。
(3)加Na2CO3调pH至5.2后过滤所得到的沉淀成分为________。
(4)萃取剂对金属离子的萃取率与pH的关系如图乙。向“滤液”中加入萃取剂的目的是________;萃取剂使用的****pH范围是________(填序号)。

A.1.0~1.5 B.2.0~2.5
C.3.0~3.5 D.4.0~4.5
(5)“沉钴”时生成CoCO3的离子方程式为____________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82 g,CO2的体积为1.344 L(标准状况),则CoxOy的化学式为________。
13.(10分)[2020·山东德州二中月考]某强酸性无色溶液中可能含下表中的若干种离子。
|
阳离子 |
Mg2+、NH4(+)、Ba2+、Al3+、Fe2+ |
|
阴离子 |
SiO3(2-)、MnO4(-)、Cl-、NO3(-)、SO3(2-) |
实验Ⅰ:取少量该溶液进行如下实验。
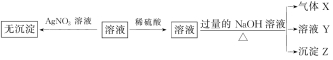
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol·L-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
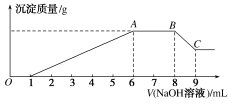
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有________种。
(2)通过实验Ⅰ可以确定该溶液中一定存在的阴离子是________。
(3)写出实验Ⅱ的图像中BC段对应的离子方程式:__________________________。
(4)A点对应的固体质量为________g。
(5)该溶液中阴离子的浓度为________mol·L-1。



