第一节 原子结构与性质
1.(2014·课标Ⅰ)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有________个未成对电子,Fe3+的电子排布式为________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1 mol乙醛分子中含有的σ键的数目为________。乙酸的沸点明显高于乙醛,其主要原因是________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度________ g·cm-3(不必计算出结果)。
解析:(1)区分晶体、准晶体和非晶体可运用X射线衍射的方法。(2)基态铁原子的3d能级上有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5,Fe(SCN)3呈血红色。(3)由乙醛的结构式(HCHHCOH)知,-CH3、-CHO上的碳原子分别为sp3、sp2杂化。由于1个乙醛分子中含有4个CH键、1个CCS键、1个CO键,共有6个σ键,故1 mol乙醛分子中含有6NA个σ键。乙酸分子之间能形成氢键而乙醛分子之间不能形成氢键,故乙酸的沸点明显高于乙醛。根据均摊原理,一个晶胞中含有的氧原子为4+6×+8×=8(个),再结合化学式Cu2O知一个晶胞中含有16个铜原子。(4)面心立方晶胞中粒子的配位数是12。一个铝晶胞中含有的铝原子数为8×+6×=4(个),一个晶胞的质量为×
答案:(1)X射线衍射 (2)4 1s22s22p63s23p63d5 血红色 (3)sp3、sp2 6NA CH3COOH存在分子间氢键 16 (4)12
2.(2014·江苏单科)含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为_____________________________________________。
(2)与OH-互为等电子体的一种分子为________________________________(填化学式)。
(3)醛基中碳原子的轨道杂化类型是________;1 mol乙醛分子中含有σ键的数目为________。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为______________________。
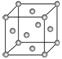 (5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如右图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如右图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
解析:(1)Cu为29号元素,Cu+基态核外电子排布式为1s22s22p63s23p63d10或3d10。(2)OH-为10电子粒子,HF为与OH-互为等电子体的分子。(3)醛基的空间构型是平面三角形,所以醛基中碳原子的轨道杂化类型为sp2。由乙醛的结构式可以得出,1个乙醛分子中含6个σ键,所以1 mol乙醛分子中含σ键6 mol即6×6.02×1023个。(4)乙醛在碱性条件下可以被氢氧化铜氧化生成乙酸,反应的化学方程式为2Cu(OH)2+CH3CHO+NaOHCH3COONa+Cu2O↓+3H2O。(5)根据铜晶胞结构示意图可以看出,在每个铜原子周围与其距离最近的铜原子每层有4个,共有3层,所以铜晶体内每个铜原子周围与其距离最近的铜原子共有12个。
答案:(1)3d10或1s22s22p63s23p63d10 (2)HF
(3)sp2 6×6.02×1023个
(4)2Cu(OH)2+CH3CHO+NaOHCH3COONa+Cu2O↓+3H2O (5)12
3.(2013·浙江自选模块)请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
|
电离能 |
I1 |
I2 |
I3 |
I4 |
…… |
|
Im/kJ·mol-1 |
578 |
1817 |
2745 |
11 578 |
…… |
则该元素是__①__(填写元素符号)。
(2)基态锗(Ge)原子的电子排布式是__②__。Ce的****价氯化物分子式是__③__。该元素可能的性质或应用有__④__。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其****价氯化物的沸点低于其溴化物的沸点
(3)关于化合物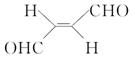 ,下列叙述正确的有__⑤__。
,下列叙述正确的有__⑤__。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2丁烯
(4)NaF中熔点__⑥__![]() BF的熔点(填>、=或<),其原因是__⑦__。
BF的熔点(填>、=或<),其原因是__⑦__。
答案:①Al
②1s22s22p63s23p63d104s24p2
③GeCl4
④C、D
⑤B、D
⑥>
⑦两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低
