课时训练6 常见物质的检验
基础夯实
1.某溶液中可能含有Cl-、S,为了检验它们,正确的操作是( )
A.先加BaCl2溶液(若有沉淀则滤去),再加AgNO3溶液
B.先加AgNO3溶液(若有沉淀则滤去),再加BaCl2溶液
C.先加Ba(NO3)2溶液(若有沉淀则滤去),再加AgNO3溶液
D.先加AgNO3溶液(若有沉淀则滤去),再加Ba(NO3)2溶液
答案:C
2.可以肯定溶液中大量存在C的实验事实是( )
A.加入硝酸银溶液时有白色沉淀
B.加入盐酸时有无色无味气体产生
C.加入氯化钙溶液时,有白色沉淀生成,再加稀盐酸时,白色沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
D.加入氢氧化钡溶液时,有白色沉淀生成,再加稀盐酸时,白色沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
答案:C
3.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四种无色溶液加以区别的一种试剂是(必要时可以加热)( )
A.BaCl2 B.NaOH C.Ba(OH)2 D.AgNO3
答案:C
4.某溶液中含有较大量的Cl-、C、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液
④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
答案:B
解析:根据三种离子的特性和逐一沉淀的思想,不能先滴加AgNO3,因AgNO3能沉淀三种离子,也不能先滴加Mg(NO3)2,因Mg(NO3)2能沉淀C、OH-,所以先用Ba(NO3)2沉淀C、过滤后用Mg(NO3)2沉淀OH-,再过滤,最后用AgNO3沉淀Cl-。
5.下列说法正确的是( )
A.某盐溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在N
B.某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl-
C.用铂丝蘸取某溶液在酒精灯上灼烧时,火焰呈黄色,说明原溶液中一定含有NaCl
D.某溶液中加入BaCl2溶液生成白色沉淀,说明原溶液中有S
答案:A
解析:B中Ag2CO3也是白色沉淀,应加HNO3排除干扰。C只能说明原溶液中含有Na+。D中没有排除S、Ag+、C的干扰,应先加入盐酸,若无沉淀,再加入BaCl2产生白色沉淀,说明原溶液中有S。
6.用简便的方法鉴别硫酸铜、碳酸钠、氧化镁三种白色粉末,应选用的试剂是( )(导学号52180061)
A.稀盐酸 B.紫色石蕊溶液
C.水 D.氢氧化钠溶液
答案:C
7.在甲、乙两烧杯溶液中,分别含有下列离子中的三种:Cu2+、Na+、H+、S、C、OH-。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )(导学号52180062)
A.C、OH-、S B.Na+、H+、S
C.Cu2+、H+、S D.Na+、OH-、C
答案:D
解析:由甲中呈蓝色可知含有Cu2+,则甲中无OH-和C。乙中除OH-和C阴离子外还应有阳离子,故应有Na+。
8.某溶液中含有硝酸镁、硝酸银、硝酸钡三种物质,为使上述三种物质分别转变为沉淀,现供使用的试剂有:Na2CO3、盐酸、NaOH三种溶液,要求每次只准使用一种试剂,过滤出一种沉淀。
(1)那么所加试剂的顺序是① ;②![]() ;③
;③![]() 。
。
(2)写出这三种物质的有关反应的化学方程式:
① ;
② ;
③ 。
答案:(1)①稀盐酸 ②NaOH溶液 ③Na2CO3溶液
(2)①AgNO3+HCl![]() AgCl↓+HNO3
AgCl↓+HNO3
②Mg(NO3)2+2NaOH![]() 2NaNO3+Mg(OH)2↓
2NaNO3+Mg(OH)2↓
③Ba(NO3)2+Na2CO3![]() 2NaNO3+BaCO3↓
2NaNO3+BaCO3↓
9.有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行以下实验:(1)取少量固体粉末加到足量水中,得到白色沉淀,上层清液为无色。(2)向(1)的悬浊液中加入足量稀硝酸,白色沉淀消失,并有气泡产生。(3)取少量(1)中的清液滴入Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。根据上述实验现象判断:该白色固体中一定含有 ,一定不含有 ,可能含有 。上述实验中有关反应的化学方程式为 、 。
答案:CaCO3、Na2SO4 CuSO4、BaCl2 KNO3
CaCO3+2HNO3![]() Ca(NO3)2+CO2↑+H2O
Ca(NO3)2+CO2↑+H2O
Na2SO4+Ba(NO3)2![]() BaSO4↓+2NaNO3
BaSO4↓+2NaNO3
解析:由(1)清液为无色,则一定没有CuSO4,因为CuSO4溶液为蓝色,粉末溶于水中得到白色沉淀,从题干中给的五种物质分析,可能是CaCO3,也可能是Na2SO4与BaCl2产生的BaSO4。由(2)白色沉淀加入HNO3后全部溶解,则为CaCO3,不是BaSO4。由(3)取少量(1)中的清液滴入Ba(NO3)2溶液产生不溶于HNO3的白色沉淀,说明原来有Na2SO4,则一定就没有BaCl2,因为Na2SO4与BaCl2会反应。综上所述,该白色固体中一定含有CaCO3、Na2SO4;一定不含有CuSO4、BaCl2,可能含有KNO3。KNO3的存在对实验不造成影响。
能力提升
10.实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠的氯化钠。某学生设计了如下方案:(导学号52180063)
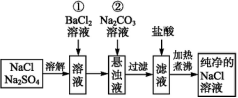
如果此方案正确,那么:
(1)操作①是否可改为加硝酸钡溶液?为什么?
(2)进行操作①后,如何判断S已除尽,方法是
。
(3)操作②的目的是 ,为什么不先过滤后再加碳酸钠溶液?理由是
。
答案:(1)否,因为改用Ba(NO3)2会使溶液中引入新的杂质N,以后操作中无法除去。 (2)取上层清液加入BaCl2溶液,若无沉淀说明S已除尽 (3)除去过量的Ba2+ 减少一次过滤操作
解析:NaCl、Na2SO4均为易溶于水的物质,要得到纯净的氯化钠溶液,可向溶液中加入BaCl2溶液,除去S,但此过程中引入了Ba2+,故需在后续过程中把Ba2+除去,可加入Na2CO3,既除去了Ba2+,又不引入新的杂质。(1)其中操作①不能改为硝酸钡溶液,因硝酸盐均为易溶于水的物质,在后续过程中无法除去N。(2)检验S是否除尽可用以下方法:取滤液的上层清液加入BaCl2溶液,若无沉淀说明S已除尽。(3)BaSO4、BaCO3均为不溶于水的白色沉淀,可在这两种物质沉淀****后进行一次过滤即可。
