课时训练7 溶液的配制及分析
基础夯实
1.地震会给当地带来巨大灾难。假若你是卫生防疫人员,需要配制0.01 mol·L-1的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是( )
A.溶解搅拌时有液体飞溅
B.取KMnO4样品时不慎在表面沾了点蒸馏水
C.定容时俯视容量瓶刻度线
D.定容摇匀后见液面下降,再加水至刻度线
答案:C
2.把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子****沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子****沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.mol·L-1 B.mol·L-1
C.mol·L-1 D.mol·L-1
答案:D
3.实验室里需用480 mL 0.1 mol·L-1硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾配成500 mL溶液
答案:D
4.将标准状况下的a L HCl (g)溶于1 000 g水中,得到的盐酸的密度为b g·mL-1,则该盐酸的物质的量浓度是( )
A.mol·L-1
B.mol·L-1
C.mol·L-1
D.mol·L-1
答案:D
解析:n(HCl)=,V[HCl(aq)]=
,
c(HCl)= mol·L-1。
5.下列说法正确的是( )
A.1 L水中溶解NaCl 0.1 mol,其物质的量浓度为0.1 mol·L-1
B.1 L溶液中含有NaOH 4 g,其物质的量浓度为4 mol·L-1
C.1 mol NaCl溶于1 L水,配成溶液,其物质的量浓度为1 mol·L-1
D.1 mol NaCl溶于水,配成1 L溶液,其物质的量浓度为1 mol·L-1
答案:D
解析:B项其物质的量浓度应为0.1 mol·L-1。
6.将50 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,稀释后溶液中溶质的物质的量浓度为( )
A.0.06 mol·L-1 B.0.03 mol·L-1
C.0.05 mol·L-1 D.0.04 mol·L-1
答案:C
解析:据稀释定律,稀释前后溶质的物质的量不变c1V1=c2V2,故答案:应为C。
7.(2015广东理综,12)****移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1 NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
答案:B
解析:滴定管应该先用标准的NaOH溶液润洗后,再装入NaOH溶液进行滴定,A项错误;锥形瓶中盛放的是盐酸,随着NaOH的加入,盐酸不断被中和至中性,所以pH由小变大,B项正确;滴定终点应该是溶液由无色变为红色,再等待半分钟不恢复原色,这时才能停止滴定,C项错误;悬滴没有进入锥形瓶中,但是在读数时,却被认为参加反应了,所以测定的HCl的浓度偏大,D项错误。
8.****配制250 mL一定物质的量浓度的NaOH溶液,下列实验操作正确的是( )
A.选择仪器时,使用500 mL容量瓶
B.将称量好的氢氧化钠固体放入容量瓶中,加入少量水溶解
C.在烧杯中溶解氢氧化钠后,立即将所得溶液注入容量瓶中
D.将烧杯中的氢氧化钠溶液注入未经干燥的洁净容量瓶中
答案:D
解析:A项应使用250 mL容量瓶;B项,容量瓶不能用于溶解固体;C项,没冷却溶液,会使结果偏高。
9.等物质的量浓度的KCl、MgCl2、AlCl3三种溶液。现欲****沉淀其中的Cl-,消耗相同物质的量浓度的AgNO3溶液的体积比为3∶2∶1,则上述三种溶液的体积比为( )
A.1∶1∶1 B.6∶3∶2
C.3∶2∶1 D.9∶3∶1
答案:D
解析:消耗AgNO3的物质的量之比为3∶2∶1,即KCl、MgCl2、AlCl3溶液中氯离子物质的量之比为3∶2∶1,故n(KCl)∶n(MgCl2)∶n(AlCl3)=3∶1∶=9∶3∶1。
10.下列有关一定物质的量浓度溶液的配制过程中的说法正确的是( )
A.在托盘天平的左右两侧各放一质量相等的纸片来称量NaOH固体的质量
B.在常温下将浓硫酸稀释后立即转入容量瓶中
C.在移液时不小心将溶液溅在外面,则所配浓度会偏小
D.定容时,仰视容量瓶刻度线,则所配浓度会偏大
答案:C
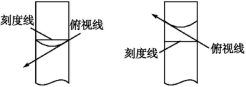
解析:A项中对腐蚀性药品、易潮解的药品不能放在纸片上称量,应放在小烧杯等玻璃容器中,否则NaOH易吸水而粘在纸片上,使溶质偏少,浓度减小;B项中浓硫酸溶于水放出大量的热,而容量瓶是****配制一定浓度溶液的仪器,上面标有使用温度,必须冷却至室温再转移溶液,否则会导致所配浓度偏高,B错;C项中溶液的溅洒造成了溶质的损失,因此浓度偏低,正确;D项中仰视读数,造成实际液面高于刻度线,溶液体积增大,浓度减小,因此错误;若俯视读数,则导致溶液体积偏小,浓度偏大,如图所示。
11.下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管;⑧细口试剂瓶;⑨标签纸。
(1)
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是 。
(3)容量瓶使用前检验是否漏水的方法是 。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①用于稀释浓硫酸的烧杯未洗涤, 。
②未经冷却时趁热将溶液注入容量瓶中, 。
③摇匀后发现液面低于刻度线再加水, 。
④容量瓶中原有少量蒸馏水, 。
⑤定容时观察液面俯视, 。
答案:(1)27.2 (2)⑤④②⑥⑦⑧⑨
(3)向容量瓶中加入适量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,观察瓶塞周围是否漏水,若不漏水,正立后把瓶塞旋转180°后塞紧,再把瓶倒立过来,若仍不漏水,才能使用
(4)①偏低 ②偏高 ③偏低 ④无影响
⑤偏高
解析:(1)设需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为V,根据稀释前后溶质的质量不变可得关系式:V×1.84 g·cm-3×98%=0.5 L×1 mol·L-1×98 g·mol-1,解得:V=27.2 mL。(2)根据配制顺序:计算→称量(或量取)→溶解(或稀释)→移液→定容→装瓶→贴标签,因此用到仪器的顺序为⑤④②⑥⑦⑧⑨。(3)按规范操作简答即可。(4)①溶质减少,浓度偏低;②未冷却,温度升高,体积膨胀,冷却至室温时,溶液体积变小,浓度偏高;③摇匀前已经定容,再加水导致V(液)偏大,浓度偏低;④配制过程还需加水,无影响;⑤俯视液面,导致V(液)减小,浓度偏高。
能力提升
12.今欲用NaHCO3固体配制480 mL 0.2 mol·L-1的NaHCO3溶液。根据题意填空:
(1)有以下仪器:①烧杯 ②量筒 ③1 000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒
⑥托盘天平(带砝码)。配制时,必须使用的仪器有 (填代号),还缺少的仪器是 、 。
(2)用托盘天平称取 g固体NaHCO3。
(3)将称好的NaHCO3固体放至500 mL的大烧杯中,倒入约250 mL蒸馏水,用玻璃棒搅拌至****溶解。 后,将烧杯中的溶液用 引流转移至容量瓶。
(4)用少量蒸馏水洗涤 2~3次,并将每次洗涤的溶液都 ,轻轻晃动容量瓶,使溶液混合均匀。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约 cm处时,改用 滴加蒸馏水至 。盖好瓶塞,摇匀。
(6)配制好的溶液 (填“能”或“不能”)****存放在容量瓶中。
(7)以下因素会造成实验结果偏低的是 。
A.定容时观察液面仰视
B.定容后发现液面低于刻度线补加蒸馏水
C.<, /SPAN>有少量NaHCO3溶液残留在烧杯中
D.容量瓶中原来有少量蒸馏水
答案:(1)①④⑤⑥ 药匙 胶头滴管
(2)8.4 (3)待冷却至室温 玻璃棒
(4)烧杯、玻璃棒 注入容量瓶
(5)1~2 胶头滴管 凹液面最低处与刻度线正好相切 (6)不能 (7)ABC
解析:没有480 mL容量瓶,故选用500 mL容量瓶,m(NaHCO3)=0.5 L×0.2 mol·L-1×84 g·mol-1=8.4 g。容量瓶不能用于溶解、盛放溶液。
