课时训练12 金属钠的性质与应用
基础夯实
1.下列实验操作正确的是( )
A.向盛水的烧杯中投入小拇指头大小的钠块,观察现象
B.将钠保存在汽油中
C.将一小块钠放在石棉网上加热,观察现象
D.用手掰开一块金属钠,观察钠的颜色
答案:C
2.为维持人体内的电解质平衡,人在大量出汗后应及时补充的离子是( )
A.Na+ B.Ca2+ C.Mg2+ D.Fe3+
答案:A
3.将一小块钠投入盛有5 mL饱和澄清石灰水的试管中,不可能观察到的现象是( )
A.钠熔成小球并在液面上到处游动
B.发出“嘶嘶”的声音
C.溶液中有银白色金属析出
D.溶液变浑浊
答案:C
4.一中学生在做钠的燃烧实验时,不小心将一大块钠引燃。下列物质能用于扑灭金属钠着火的是( )
A.干冰 B.黄沙
C.干粉(含NaHCO3)灭火剂 D.泡沫灭火剂
答案:B
解析:用于扑灭金属钠着火的灭火剂不能产生CO2和H2O;干冰为固体CO2,而钠燃烧后的Na2O2与CO2反应产生O2,使火更旺,所以A错;同样,C、D选项都会产生CO2,所以为错误选项。
5.等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量****
D.两块钠的反应产物质量一样大
答案:B
解析:钠在氧气中加热生成过氧化钠,不加热则生成氧化钠及少量过氧化钠,产物中的钠元素只显+1价。解题时要钠与氧气反应随温度不同产物不同,等质量的钠被氧化时失去相同数目的电子,等质量的钠生成过氧化钠时结合的氧多,产物质量大。
6.保存少量金属钠的方法是( )
A.放在冰水中 B.放在细沙中
C.放在水中 D.放在煤油中
答案:D
解析:钠的密度比水小,比煤油大。
7.将一小块钠投入下列溶液时,既能产生气体又会出现沉淀的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸钾溶液 D.氯化镁溶液
答案:D
解析:A项,2Na+H2SO4![]() Na2SO4+H2↑;B项,2Na+2H2O
Na2SO4+H2↑;B项,2Na+2H2O![]() 2NaOH+H2↑;C项,2Na+2H2O
2NaOH+H2↑;C项,2Na+2H2O![]() 2NaOH+H2↑;D项,2Na+2H2O
2NaOH+H2↑;D项,2Na+2H2O![]() 2NaOH+H2↑、2NaOH+MgCl2
2NaOH+H2↑、2NaOH+MgCl2![]() Mg(OH)2↓+2NaCl。
Mg(OH)2↓+2NaCl。
8.将2.3 g金属钠放入100 g水中,****反应后溶液的质量分数为( )(导学号52180080)
A.×100% B.×100%
C.×100% D.×100%
答案:D
解析:2Na+2H2O![]() 2NaOH+H2↑
2NaOH+H2↑
46 80 2
2.3 g 4 g 0.1 g
w(NaOH)=×100%。
9.
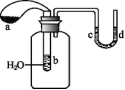
如右图所示,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水。将气球用橡皮绳紧系在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )(导学号52180081)
A.U形管内的红水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管中水位d<c
答案:C
解析:此题解答时容易因定向思维而错选AB,而没有注意到浅红色的水是在U形管中而非试管中。由于发生反应:2Na2O2+2H2O![]() 4NaOH+O2↑,产生的O2使气球被吹大,同时该反应放出大量的热,使广口瓶中空气受热膨胀而导致U形管中水位d>c。
4NaOH+O2↑,产生的O2使气球被吹大,同时该反应放出大量的热,使广口瓶中空气受热膨胀而导致U形管中水位d>c。
10.下列对于Na2O2的叙述中,正确的是( )
A.Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
B.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
C.Na2O2与水反应时,Na2O2是氧化剂,水是还原剂
D.Na2O2与二氧化碳反应时,Na2O2既是氧化剂又是还原剂
答案:D
解析:能和酸反应,只生成盐和水的氧化物叫碱性氧化物。而Na2O2和酸反应,除生成盐和水外,还有氧气生成,例如:2Na2O2+4HCl![]() 4NaCl+2H2O+O2↑,所以Na2O2不是碱性氧化物,A错。虽然Na2O2可吸收水蒸气,但在吸收水的同时还有氧气生成,即2Na2O2+2H2O
4NaCl+2H2O+O2↑,所以Na2O2不是碱性氧化物,A错。虽然Na2O2可吸收水蒸气,但在吸收水的同时还有氧气生成,即2Na2O2+2H2O![]() 4NaOH+O2↑,从而使被干燥的气体中混有氧气。Na2O2只可以干燥氧气,但一般不用Na2O2进行干燥,B错。Na2O2与水、二氧化碳等物质发生化学反应时,电子转移都发生在Na2O2中氧元素的两个原子之间:[O—O]2-,其中的一个氧原子失1个电子,化合价从-1升高到0,另一个氧原子得1个电子,化合价从-1降到-2。所以在这些反应中,Na2O2既是氧化剂,又是还原剂,C错,D对。
4NaOH+O2↑,从而使被干燥的气体中混有氧气。Na2O2只可以干燥氧气,但一般不用Na2O2进行干燥,B错。Na2O2与水、二氧化碳等物质发生化学反应时,电子转移都发生在Na2O2中氧元素的两个原子之间:[O—O]2-,其中的一个氧原子失1个电子,化合价从-1升高到0,另一个氧原子得1个电子,化合价从-1降到-2。所以在这些反应中,Na2O2既是氧化剂,又是还原剂,C错,D对。
11.A、B、C是三种常见的化合物,A为淡黄色固体。它们之间的转化关系如图所示:(导学号52180082)
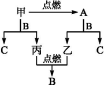
完成下列空白:
(1)A的化学式 ,B的化学式 。
(2)写出甲+B![]() C+丙的化学方程式 。
C+丙的化学方程式 。
(3)写出A的一种重要用途 。
答案:(1)Na2O2 H2O
(2)2Na+2H2O![]() 2NaOH+H2↑
2NaOH+H2↑
(3)呼吸面具中作供氧剂(或漂白剂)
解析:由A为淡黄色固体推断A可能为Na2O2,则由甲![]() A(Na2O2),推知甲可能为Na;由于Na、Na2O2均与化合物H2O反应,可推知B为H2O,则C为NaOH,乙为O2,丙为H2,经丙+乙
A(Na2O2),推知甲可能为Na;由于Na、Na2O2均与化合物H2O反应,可推知B为H2O,则C为NaOH,乙为O2,丙为H2,经丙+乙![]() B(H2O)验证,上述推断合理。即A、B、C分别为Na2O2、H2O、NaOH;甲、乙、丙分别为Na、O2、H2。
B(H2O)验证,上述推断合理。即A、B、C分别为Na2O2、H2O、NaOH;甲、乙、丙分别为Na、O2、H2。
能力提升
12.(1)如图1所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气。过一段时间后可观察到 ,发生反应的化学方程式为 。
(2)某班同学用如图2所示装置测定空气里氧气的含量。先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。
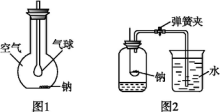
①上述实验过程中发生反应的化学方程式为 。
②实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学的广口瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是 。
a.甲同学可能使用钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却时外界空气进入瓶内
c.乙同学可能没夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
答案:(1)钠表面变灰暗,气球膨胀 4Na+O2![]() 2Na2O
2Na2O
(2)①2Na+O2![]() Na2O2 ②abcd
Na2O2 ②abcd
解析:(1)钠与空气中的氧气反应生成Na2O,使钠表面变灰暗,同时烧瓶内压强降低,气球会膨胀。
(2)a项,若钠的量不足,则氧气消耗不完,造成进水量少于容器容积的1/5,结果偏低,合理。b项,若瓶塞未塞紧,钠熄灭冷却,瓶内气体收缩,外面的空气会进入瓶内,使气体得到补充,造成结果偏低,合理。c项,若弹簧夹未夹紧,钠燃烧时,瓶内气体膨胀,使部分气体从导管口逸出,造成结果偏高,合理。d项若插入燃烧匙太慢,钠燃烧时,瓶内气体膨胀,在塞紧瓶塞前,瓶内部分气体从瓶口逸出,造成结果偏高,合理。
