一轮复习化学反应原理----电化学
原电池原理及应用
【考试说明】
1.理解原电池的工作原理;
2.能写出常见的简单电极反应和电池反应方程式。
3.了解常见的化学电源,认识化学能与电能相互转化的实际意义及其重要应用。
4.认识金属腐蚀的危害,理解金属发生电化学腐蚀的原因,能选用恰当的措施防止铁、铝等金属腐蚀。
一、原电池
1、概念:原电池是将 能转变为 能的装置。
2、构成条件:
思考与交流:下列装置中,能组成原电池的是:____________________________
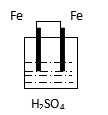
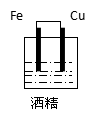
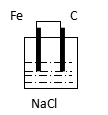
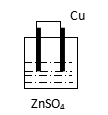


A B C D E F
例1:在理论上不能用于设计原电池的化学反应是( )
A、HCl ( aq ) + NaOH ( aq ) = NaCl ( aq ) + H2O ( l ) △H < 0
B、2CH3OH ( l ) +3O2 ( g ) = 2CO2 ( g ) + 4H2O ( l ) △H < 0
C、4Fe (OH)2 ( s ) + 2H2O ( l ) + O2 ( g ) = 4Fe (OH)3( s ) △H < 0
D、2H2 ( g ) + O2 ( g ) = 2H2O ( l ) △H < 0
例2:某原电池的总反应为:2Fe3++Fe == 3Fe2+,不能实现该反应的原电池组成是( )
A、正极为铜,负极为铁,电解质溶液为FeCl3溶液
B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C、正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D、正极为银,负极为铁,电解质溶液为CuSO4溶液
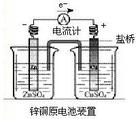 二、原电池工作原理
二、原电池工作原理
1、分析Zn-Cu原电池,回答下列问题:
在ZnSO4溶液中,锌片失去电子而逐渐 ,形成
进入溶液,电子经导线流向 ,溶液中的 得电子被
还原成 。这一变化可以表示如下:
锌片: 铜片:
思考与交流:电池装置中盐桥的作用是什么?
2、原电池中电荷的移动方向
外电路: 内电路:
3、电极的判断
(1)根据电极材料: (2)根据电极反应:
(3)根据电子流动方向或电解质溶液中离子移动方向: (4)根据反应现象:
例3:将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成CH4燃料电池。已知通入CH4的一极,其电极反应式是:CH4+10OH--8e-===CO32-+7H2O;通入O2的另一极,其电极反应是:O2+2H2O+4e-===4OH-,下列叙述不正确的是( )
A.通入CH4的电极为负极 B.正极发生氧化反应
C.燃料电池工作时溶液中的阴离子向负极移动D.该电池使用一段时间后应补充KOH
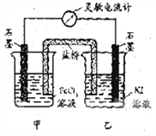 感悟高考:1、(09福建理综)控制适合的条件,将反应2Fe3++2I-=2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
感悟高考:1、(09福建理综)控制适合的条件,将反应2Fe3++2I-=2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中加FeCl2固体,乙中石墨电极为负极
4、电极反应式的书写:
感悟高考:2. (广东化学14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
感悟高考:3.(海南化学卷) 依据氧化还原反应: 2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题: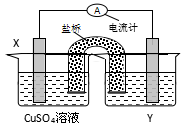
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为______________________________;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
三、化学电源
1、一次电池:锌锰碱性电池
电池组成:负极 ,正极 ,电解质溶液 。
2、二次电池:铅蓄电池
工作原理:
3、燃料电池:氢氧燃料电池