例1:实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO![]() ===PbSO4+2e-,正极PbO2+4H++SO
===PbSO4+2e-,正极PbO2+4H++SO![]() +2e-===PbSO4+2H2O今若制得Cl20.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-===PbSO4+2H2O今若制得Cl20.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
例2:氢氧燃料电池以H2为还原剂,O2为氧化剂,电极为多孔镍,电解液为30%的KOH溶液,下列有关叙述正确的是 ( )
①负极反应为4OH——4e=O2↑+2H2O ②负极反应H2+2OH—-2e=2H2O
③工作时正极区PH升高,负极区PH降低 ④工作时溶液中阴离子移向正极
A、③④ B、②③ C、②④ D、①④
感悟高考
四、原电池原理的利用
1、利用原电池原理设计各种实用电池
例3:利用反应:2FeCl3 + Cu==2FeCl2 + CuCl2,选择适宜的材料和试剂,设计一个原电池。
可供选择的电极材料:铁棒、铜棒、石墨棒
可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液
请填写下列空白:(1)选用 做正极材料, 做负极材料,选用 做该原电池的电解质溶液。
(2)写出有关的电极反应式:正极: ;负极: 。
2、原电池原理可用于解决一些实际问题,如加快某些化学反应时的速率(稀硫酸与锌反应时,常滴入几滴硫酸铜溶液);比较金属的活动性;分析金属电化学腐蚀的快慢和防护方法等。
例4:X、Y、Z、M、N分别代表五种金属。有以下化学反应
①水溶液中:X+Y2+ === X2++Y ②Z+2H2O(冷)=== Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M→M2++2e-
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活动性由弱到强的顺序( )A.N<M<Y<X<Z B.N<M<X<Y<Z C.M<N<Y<X<Z D.X<Z<N<M<Y
三、金属的腐蚀和防护
1、金属腐蚀的含义:
2、化学腐蚀和电化腐蚀的区别:
3、钢铁的析氢腐蚀和吸氧腐蚀:
4、金属腐蚀的防护方法:
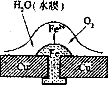 例5:铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
例5:铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
A.负极电极反应式为:Fe-3e-=Fe3+
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
作业
1、①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极,②④相连时,②有气泡逸出 ;③ ④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是
A ①③②④ B ①③④② C ③ ④ ②① D ③ ① ②④
2.(2011北京高考8)结合下图判断,下列叙述正确的是
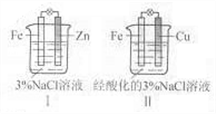 A.Ⅰ和Ⅱ中正极均被保护
A.Ⅰ和Ⅱ中正极均被保护
B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D. Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
3.(2011福建高考11)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成
C.放电时OH-向正极移动 D.总反应为:2Li+2H2O=== 2LiOH+H2↑
4.(2011海南)根据下图,下列判断中正确的是
 A.烧杯a中的溶液pH升高
A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e![]() -=H2
-=H2
D.烧杯b中发生的反应为2Cl--2e-=Cl2
5.以Li2CO3和Na2CO3熔融物为电解质,一极通入CO,另一极通入CO2和O2,组成燃料电池。则下列说法中,正确的是
A.正极反应为:O2+2CO2+4e-→2CO32-
B.负极反应为:CO+4OH--2e-→CO32-+2H2O
C.正极反应为:O2+4e→2O2- D.负极反应为:CO+CO32--2e-→2CO2
6.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
电解原理及应用
【考试说明】
1.理解电解池的工作原理,能写出常见的简单电极反应和反应方程式。
2.认识化学能与电能相互转化的实际意义及其重要应用
一、电解
1、定义:
2、电解装置—电解池(槽)
(1)定义:
(2)构成条件:
(3)能量转化方式:
(4)电极名称、电极判断和电极反应类型:
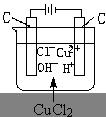 左边石墨棒电极名称: ,电极反应类型:
左边石墨棒电极名称: ,电极反应类型:
右边石墨棒电极名称: ,电极反应类型:
电解质溶液中离子的迁移方向:
二、电解原理
1、离子放电顺序(惰性电极通常包括 和 等)
阴极 阳离子放电顺序:Ag+ > Hg 2+> Fe 3+> Cu 2+ >H+> Pb 2+ >Sn 2+ >Fe 2+ >Zn 2+>
Al 3+ >Mg 2+>Na+ >Ca 2+ >K+
阳极 阴离子放电顺序:S2- > I- > Br- >Cl- > OH- > 含氧酸根> F-
思考与交流:①上述阳离子顺序与离子的氧化性或金属活动性顺序有何联系?上述阴离子顺序与离子的还原性有何联系?
②若用铜做电极,阳极的放电情况会怎么样?
2、电极反应式书写
例1:试写出以石墨为电极分别电解下列溶液的电极反应式和电解总方程式:
(1)NaCl溶液
(2)CuSO4溶液
(3)NaOH溶液
(4)K2SO4溶液
(5)CuCl2溶液
3、电解规律(惰性电极)
|
类型 |
实例 |
电极反应特点 |
电解对象 |
电解质浓度 |
pH |
溶液复原 |
|
电解水 |
||||||
|
电解电解质 |
||||||
|
放H2生碱 |
||||||
|
放O2生酸 |
例2:如图所示,下列叙述正确的是( )
A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
感悟高考:1.某同学按右图所示的装置进行电解实验。下列说法正确的是( )
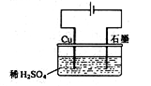 A.电解过程中,铜电极上有H2产生
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4![]() CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
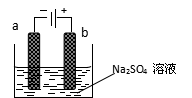 2.右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是
2.右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
三、电解原理的应用
1、铜的电解精炼:
作阳极, 作阴极, 作电解质溶液。
电极反应式 : 阳极 ,阴极 。
思考与交流:①精炼过程中比铜活泼的Zn将如何?比铜不活泼的Ag等杂质将如何?电解液的浓度将如何?
②若阴极析出增重6.4克,则转移电子是否一定为0.2NA?若阳极减轻6.4克,则转移电子是否一定为0.2NA?
2、电镀铜
电镀材料的选择:(试以在铁件上镀铜为例)
阳极: ,阴极: 。电镀液:
思考与交流:电镀过程中,电镀液中离子浓度变化如何?如何使镀层更光亮和精美?电镀液能否直接排放?电镀的优点: 。
小结:电镀过程的特点:①牺牲阳极;②电镀液的浓度(严格说是镀层金属离子的浓度)保持不变;③在电镀的条件下,水电离产生的H+、OH—一般不放电。
“三池”比较
|
内容 |
原电池 |
电解池 |
电镀池 |
|
装置图 |
|||
|
形成条件 |
|||
|
两电极名称及反应 |
|||
|
电子流向 |
|||
|
电解液变化 |