练习、电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液![]() ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
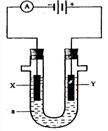 (1)若X、Y都是惰性电极,
(1)若X、Y都是惰性电极,![]() 是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①X极上的电极反应式为__ _。在X极附近观察到的现象是 。
②Y电极上的电极反应式为_______ __,检验该电极反应产物的方法是__ __。
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是_______,电极反应式为______ ____。
②Y电极的材料是_______,电极反应式为_____ ______。
作业
1、下列叙述正确的是
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
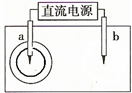 2、取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现电极a与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的是
2、取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现电极a与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的是
A.b电极是阴极 B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂 D.b电极附近溶液的pH变小
3、(电化学、计算)以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出Cu的质量为
(A)0.64 g (B)1.28 g (C)2.56 g (D)5.12 g
4、 如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
 (1)打开K2,闭合K1。
(1)打开K2,闭合K1。 B为 极,A的电极反应为 ,最终可观察到的现象是 ,涉及的化学反应方程式有: ;
B为 极,A的电极反应为 ,最终可观察到的现象是 ,涉及的化学反应方程式有: ;
(2)打开K1,闭合K2。E为___________极,F极的电极反应为 ,检验F极产生气体的方法是___________ _______ 。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是__________,原因是________________________
一轮复习化学反应原理----化学反应速率化学平衡
化学反应速率
【考试说明】1、了解化学反应速率的概念和平均反应速率的定量表示方法。
2、了解温度、浓度、压强和催化剂等影响化学反应速率的一般规律。
3、认识催化剂在生产、生活和科学研究领域中的重大作用。
一、化学反应速率的概念及其表示方法
1、概念:化学反应速率通常用单位时间内反应物浓度的 或生成物浓度的
来表示。
2、计算公式:
3、单位:
4、注意点:
![]()
![]() 【例1】反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
【例1】反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
A、v(NH3)=0.010mol·L—1·s—1 B、v(O2)=0.0010mol·L—1·s—1
C、v(NO)=0.0010mol·L—1·s—1 D、v(H2O)=0.045mol·L—1·s—1
二、影响化学反应速率的因素
1.影响化学反应速率的因素
决定因素:
外在因素:当其它条件不变时
(1)浓度的影响:增加反应物的浓度可以 化学反应速率;
(2)压强的影响:(仅适用于有气体参加的反应)增加体系的压强,可以 化学反应速率;
(3)温度的影响:升高体系的温度可以 化学反应速率;
(4)催化剂:使用催化剂同等程度的增大正逆反应速率,从而改变反应到达平衡所需时间。
2.压强对气体反应体系的影响
![]()
![]()
![]()
(1)恒温时:增加压强 缩小 增大 反应速率加快。
![]()
![]()
![]() (2)恒容时
(2)恒容时
![]() ①充入气体反应物 增大 总压增大 速率加快。
①充入气体反应物 增大 总压增大 速率加快。
②充入“惰气” 但各物质的浓度不变,反应速率不变。
![]()
![]()
![]() (3)恒压时
(3)恒压时
充入“惰气” 增大 各反应物 减少 反应速率减慢。
思考与交流:N2 + 3H2==2NH3反应在密闭容器中进行
1、容器若为恒定容器,在容器内充入惰性气体,则化学反应速率_____(加快、不变、减慢),原因是_________
2、容器若为恒压容器,在容器内充入惰性气体,则反应速率(加快,不变,减慢)_____,原因是________ 。
![]()
![]() 【例2】设C(s)+CO2(g) 2CO(g)的反应速率为v1,N2(g)+3H2(g) 2NH3(g)的反应速率为v2,对于上述反应,当只增大反应体系的压强时,v1和v2的变化情况为 ( )
【例2】设C(s)+CO2(g) 2CO(g)的反应速率为v1,N2(g)+3H2(g) 2NH3(g)的反应速率为v2,对于上述反应,当只增大反应体系的压强时,v1和v2的变化情况为 ( )
A、同时增大 B、同时减小 C、v1减小,v2增大 D、v1不变,v2增大
【例3】在10℃时,某化学反应速率为0.1mol·L—1·s—1,若温度每升高10℃,反应速率增加到原来的
A、30℃ B、40℃ C、50℃ D、60℃
感悟高考:1、(广东)已知汽车尾气无害化处理反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
A.升高温度可使该反应的逆反应速率降低 B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
2、某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、< =,且C3 1.0mol/L(填>、=、<=
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
作业1.(09年福建)某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验 序号 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s | ||
|
CH3COCH3 |
HCl |
Br2 | ||
|
① |
0.80 |
0.20 |
0.0010 |
290 |
|
② |
1.60 |
0.20 |
0.0010 |
145 |
|
③ |
0.80 |
0.40 |
0.0010 |
145 |
|
④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是
A.增大c(CH3COCH3), v(Br2)增大 B.实验②和③的v(Br2)相等
C.增大c(HCl), v(Br2)增大 D.增大c(Br2),v(Br2)增大
2.已知N2+3H2![]() 2NH3 △H<O ,反应速率为V1;2HI
2NH3 △H<O ,反应速率为V1;2HI![]() H2+I2 △H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
H2+I2 △H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
A.同时增大 B.同时减小
C.V1增大,V2减小 D.V1减小,V2增大
3.在2A(g)+ B(g)= 3C(g)+ 4D(g)的反应中,下列表示该反应速率****的是
A.VA =0.5mol / (L.min) B.VB=1.8mol / (L. min)
C.VC =1mol / (L.S) D.VD = 2mol / (L.min)
![]() 4.可逆反应:CO(g)+NO2(g) CO2(g)+NO(g);△H=-226kJ/mol,在下列情况下不能使逆反应速率加快的是
4.可逆反应:CO(g)+NO2(g) CO2(g)+NO(g);△H=-226kJ/mol,在下列情况下不能使逆反应速率加快的是
A.充入NO2 B.升高温度
C.充入Ar气体使体系压强增大 D.缩小容器体积
5.(08年海南)X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y![]() 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于
A.33% B.40% C.50% D.66%