化学反应进行的方向
【考试说明】
1、能用焓变和熵变说明常见化学反应的方向。
2、认识催化剂在生产、生活和科学研究领域中的重大作用。
3、认识化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
【教学设计】
一、化学反应进行的方向
1.自发过程
(1)含义:在一定条件下不借助外部力量就能自动进行的过程。
(2)特点: ① 体系趋向于从 状态转变为 状态。
② 在密闭条件下,体系趋向于从 状态转变为 状态。
2.化学反应方向的判据
(1)焓判据
① 用 判断反应进行的方向。
② 焓减原理:自发反应的∆H 0,绝大多数放热反应都能自发进行,且反应放出的热量越多,体系能量降低得也越多,反应越****。
(2)熵判据
① 用 判断反应进行的方向。自发反应的∆S 0
② 熵:描述体系 的物理量,用符号S表示
③ 熵增原理:在与外界隔离的体系中,自发过程将导致体系的熵增大。大多数熵增加反应都能自发进行,且反应的熵增加越多,体系混乱度增加越多,反应越****。产生气体的反应、气体物质的物质的量增大的反应,熵变通常都是正值( △S >0),为熵增加反应。
④ 熵的大小:在同一条件下,不同物质的熵不同;同一物质的熵与其聚集状态及外界条件有关,同一种物质,三种状态下,熵值的大小顺序为:气态 液态 固态
(3)焓判断和熵判断的复合判据(自由能变化):
△ G=△H—T △S
ΔH-TΔS<0 反应
ΔH-TΔS = 0 反应
ΔH-TΔS>0 反应
在温度、压强一定的条件下,自发反应总是向ΔH-TΔS<0的方向进行,直至达到平衡状态。
【例1】下列过程是非自发的是∶( )
A、水由高处向低处流; B、天然气的燃烧;
C、铁在潮湿空气中生锈; D、室温下水结成冰
【例2】 碳酸铵〔(NH4)2CO3〕在室温下就能自发地分解产生氨气,对其说法中正确的是∶
A、其分解是因为生成了易挥发的气体,使体系的熵增大;B、其分解是因为外界给予了能量;
C、其分解是吸热反应,据能量判据不能自发分解;D、碳酸盐都不稳定,都能自发分解。
![]() 【例3】某工业生产中发生反应:2A(g)+B(g) 2M(g),△H<0。下列有关该工业生产的说法正确中的是 ( )
【例3】某工业生产中发生反应:2A(g)+B(g) 2M(g),△H<0。下列有关该工业生产的说法正确中的是 ( )
A、工业上在合成M时,一定采用高压条件,因为高压有利于M的生成
B、若物质B价廉易得,工业上一般采用加入过量的B,以提高A和B的转化率
C、工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D、工业生产中常采用催化剂,因为使用催化剂可提高M的日产量
作业1.下列说法正确的是 ( )
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.自发反应在任何条件下都能实现
C.自发反应在恰当条件下才能实现
D.自发反应一定是熵增大,非自发反应一定是熵减少或不变
2.250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应。
3.下列关于化学反应的自发性叙述中正确的是 ( )
A.焓变小于0而熵变大于0的反应肯定是自发的 B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的 D熵变小于0而焓变大于0的反应肯定是自发的
4.下列反应是自发进行的吸热反应的是 ( )
A.NaOH+HCl=NaCl+H2O B.NH4Br(s)=NH3(g)+HBr(g)
C.2CO+O2=CO2 D.C(s)+H2O(g)=CO(g)+H2(g)
5.乙酸蒸气能形成二聚分子:2CH3COOH(g) ![]() (CH3COOH)2(g) ,△H<0。现欲测定乙酸的式量,应采取的措施是
(CH3COOH)2(g) ,△H<0。现欲测定乙酸的式量,应采取的措施是
A.高温低压 B.低温高压 C.低温低压 D.高温高压
6.一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )
(A)16.7% (B)20.0% (C)80.0% (D)83.3%
7.下列过程属于熵增加的是 ( )
A.一定条件下水由气态变为液态 B.高温高压条件下使石墨转化为金刚石
C.散落的火柴的无序排列 D.CO点燃时生成CO2
化学平衡的标志和特征
【考试说明】
1、理解化学平衡的含义。
2、理解浓度、温度、压强、催化剂等对化学平衡影响的一般规律。
一、可逆反应
1、定义:
![]() 【例1】当可逆反应2SO2+O2 2SO3达到平衡后,通入18O2,再次达到平衡时,18O存在于哪些分子中
【例1】当可逆反应2SO2+O2 2SO3达到平衡后,通入18O2,再次达到平衡时,18O存在于哪些分子中
A、SO3、O2 B、SO2、SO3 C、SO2、SO3、O2 D、SO2、O2
二、化学平衡状态
1、化学平衡的研究对象:
2、化学平衡状态的概念:
【例2】在一定条件下,某容器中充入N2和H2合, , 成NH3,以下叙述中错误的是 ( )
A、开始反应时,正反应速率****,逆反应速率为零
B、随着反应的进行,正反应速率逐渐减小,最后正反应速率减小为零
C、随着反应的进行,逆反应速率逐渐增大,最后保持恒定
D、随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
3、几点说明:
(1)可逆反应是前提,速率相等是实质,浓度保持不变是标志。
(2)v正=v逆≠0,正反应和逆反应仍在进行中,是一种动态平衡。
(3)百分含量指各组分的质量分数、物质的量分数、气态物质的体积分数。
(4)各组分是指平衡体系中每一组分(除固体和纯液体外),当某一组分的百分含量发生变化时,一定未达到平衡状态。
(5)保持不变是指不再变化,但不一定相等。
4、化学平衡状态的特征:逆、动、等、定、变
5、化学平衡状态的标志
(1)“v正=v逆”为标志
(2)“各组分的百分含量保持不变”为标志
(3)“转化率不变”为标志
6、化学平衡状态的判断
![]() 以可逆反应“mA(g)+ nB(g) pC(g)+qD(g)”为例,判断下列各种情况下反应是否达到平衡状态。
以可逆反应“mA(g)+ nB(g) pC(g)+qD(g)”为例,判断下列各种情况下反应是否达到平衡状态。
|
是否平衡 | ||
|
混合体系中各组分的含量 |
①各组分的物质的量或物质的量分数一定 |
|
|
②各组分的质量或质量分数一定 |
||
|
③各气体的体积或体积分数一定 |
||
|
④总体积、总压强、总物质的量一定 |
||
|
正逆反应速率 的关系 |
①在单位时间内消耗了n mol A,同时也生成了n mol A |
|
|
②在单位时间内生成了n mol C,同时也消耗了n mol C |
||
|
③v(A)=v(B)=v(C)=v(D)=m∶n∶p∶q |
||
|
④在单位时间内消耗了n mol B,同时也生成了q mol D |
||
|
压强 |
①当m+n≠p+q时,总压强一定(其他条件不变) |
|
|
②当m+n=p+q时,总压强一定(其他条件不变) |
||
|
|
|
|
|
|
||
|
温度 |
任何化学反应都伴随着能量变化,当体系温度一定时(其他条件不变) |
|
|
气体的密度 |
密度一定 |
|
|
颜色 |
反应体系内有色物质的颜色稳定不变 |
![]() 【例3】可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
【例3】可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A、3v正(N2)=v正(H2) B、v正(N2)=v逆(NH3) C、2v正(H2)=3v逆(NH3) D、v正(N2)=3v逆(H2)
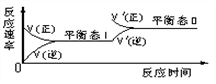 感悟高考:(全国)如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
感悟高考:(全国)如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
(A)反应达平衡时,正反应速率和逆反应速率相等
(B)该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
(C)该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
(D)同一种反应物在平衡态I和平衡态II时浓度不相等
作业
![]() 1、一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
1、一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
A、X、Y、Z的物质的量之比为1∶2∶2 B、X、Y、Z的浓度不再发生变化
C、容器中的压强不再发生变化 D、单位时间内生成2nmol Z同时消耗2nmol Y
![]() 2、下列说法能说明反应P(g)+Q(g) S(g)+R(g)在恒温恒容的密闭容器中已达平衡的是
2、下列说法能说明反应P(g)+Q(g) S(g)+R(g)在恒温恒容的密闭容器中已达平衡的是
A、容器里P、Q、R、S四种物质共存 B、容器里Q、R的体积分数不再改变
C、容器内气体压强、密度不随时间变化 D、单位时间内生成nmolP同时生成nmolS
![]() 3、在密闭容器中进行如下的反应:X2(g)+Y2(g) 2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L—1,0.2mol·L—1,0.2mol·L—1,在一定条件下,当反应达平衡时,各物质的浓度有可能是 &a, mp;nbs, p;
3、在密闭容器中进行如下的反应:X2(g)+Y2(g) 2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L—1,0.2mol·L—1,0.2mol·L—1,在一定条件下,当反应达平衡时,各物质的浓度有可能是 &a, mp;nbs, p;
A、Z为0.3mol·L—1 B、Y2为0.35mol·L—1 C、X2为0.3mol·L—1 D、Z为0.4mol·L—1
![]() 4、下列哪种说法可以证明反应N2+3H2 2NH3已达到平衡状态
4、下列哪种说法可以证明反应N2+3H2 2NH3已达到平衡状态
A、1个N≡N键断裂的同时,有3个H—H键形成
B、1个N≡N键断裂的同时,有3个H—H键断裂
C、1个N≡N键断裂的同时,有6个N—H键断裂
D、1个N≡N键断裂的同时,有6个N—H键形成
![]() 5、可逆反应:2NO2 2NO+O2在密闭容器中进行,达到平衡状态的标志是
5、可逆反应:2NO2 2NO+O2在密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A、①④⑥ B、②③⑤ C、①③④ D、①②③④⑤⑥