化学平衡移动原理和应用(两课时)
【考试说明】
1、了解化学反应的可逆性。理解化学平衡的含义。
2、理解浓度、温度、压强、催化剂等对化学平衡影响的一般规律。
一、化学平衡移动
1、化学平衡移动的概念
2、化学平衡移动的方向
当改变反应条件后,化学平衡移动的方向如下:
v(正)>v(逆),化学平衡向 移动
v(正)<v(逆),化学平衡向 移动
v(正)=v(逆),化学平衡 移动
二、影响化学平衡移动的条件
1、浓度对化学平衡的影响
【结论】在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向 移动;减小反应物的浓度或增大生成物的浓度,都可以使化学平衡向 移动。
2、压强对化学平衡的影响
【结论】在其他条件不变的情况下,增大压强,会使化学平衡向着气体体积 的方向移动;减小压强,会使化学平衡向着气体体积 的方向移动。
思考与交流:恒温恒容下通入稀有气体平衡如何移动?
3、温度对化学平衡的影响
【结论】在其他条件不变的情况下,升高温度,会使化学平衡向着 的方向移动;降低温度,会使化学平衡向着 的方向移动。
4、催化剂对化学平衡的影响
【结论】催化剂能同等程度地改变化学反应的速率,故化学平衡不发生移动,但是可以改变达到化学平衡的时间。
【例1】下列改变一定可以判断化学平衡发生移动的是
A、反应混合物各组分的浓度发生改变 B、反应物的转化率发生改变
C、正、逆反应速率发生改变 D、平衡体系中气体混合物的密度发生改变
![]() 【例2】一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达平衡后,保持温度不变,将容器的体积缩小为原来的1/2,当达到新平衡时,测得C的浓度为原来的1.9倍。则下列叙述中正确的是 ( )
【例2】一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达平衡后,保持温度不变,将容器的体积缩小为原来的1/2,当达到新平衡时,测得C的浓度为原来的1.9倍。则下列叙述中正确的是 ( )
A、m+n>p B、A的转化率增大 C、平衡逆向移动 D、C的体积百分含量增大
【例3】对某一可逆反应来说,使用催化剂的作用是
A、提高反应物的平衡转化率 B、增大正反应速率,减小逆反应速率
C、以同样程度改变正逆反应的速率 D、改变平衡混合物的组成
三、速率---时间图像及应用
对于可逆反应,外界条件变化对v正,v逆的影响
(1)温度升高v正 ,v逆 ,
吸热反应增加的倍数 放热反应增加的倍数。
温度下降,v正 ,v逆 ,
吸热反应减少的倍数 放热反应减小的倍数。
(2)对有气体参与的反应,加压时v正 ,v逆 ,
气体体积之和大的一侧增加倍数 气体体积之和小
的一侧增加的倍数。降压时v正 ,v逆 ,
气体体积之和大的一侧减小的倍数 气体体积
之和小的一侧减小的倍数。
(3)浓度:反应物浓度增大,则v正急剧
v逆逐渐 。
(4)催化剂可同等倍数地改变v正和v逆。
![]() 【例4】一定条件下,可逆反应:N2+3H2 2NH3(正反应放热)达平衡,当单独改变下列条件后,有关叙述错误的是 ( )
【例4】一定条件下,可逆反应:N2+3H2 2NH3(正反应放热)达平衡,当单独改变下列条件后,有关叙述错误的是 ( )
A、加催化剂,v正,v逆皆发生变化且变化的倍数相等
B、加压,v正,v逆皆增大,且v正增大倍数大于v逆增大倍数
C、降温,v正, v逆皆减小,且v正减小倍数大于v逆减小倍数
D、加入氢气,v正,v逆皆增大,且v正增大倍数大于v逆增大倍数
四、勒夏特列原理
1、勒夏特列原理
2、勒夏特列原理的适用范围——所有动态平衡体系
(1)可逆反应的化学平衡(2)弱电解质的电离平衡(3)难溶物的溶解平衡
【例4】下列事实不能用勒夏特列原理解释的是
A、氨水应密封保存存放置于低温处 B、在FeCl2的溶液中加入铁粉以防止氧化
C、生成HNO3的过程中使用过量的空气以提高NO2的转化率
D、实验室用排饱和食盐水的方法收集Cl2
感悟高考:(09年北京)已知:H2(g)+I2(g)![]() 2HI(g);△H < 0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g);△H < 0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变 D.甲增加0.1 mol H2,乙增加0.1 mol I2
作业
1、对平衡CO2(g)![]() CO2(aq) .△H=-19.75kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq) .△H=-19.75kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是
A.升温增压 B.降温减压 C.升温减压 D.降温增压
2、对于已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的体积分数一定增加;②生成物的产量一定增加;③反应物的转化率一定增大;
④反应物浓度一定降低;⑤正反应速率一定大于逆反应速度;⑥使用了合适的催化剂。
A、①② B、②⑤ C、③⑤ D、④⑥
3、在FeCl3溶液中滴加无色的KSCN溶液后,有以下可逆反应存在;
![]() FeCl3+3KSCN Fe(SCN)3+3KCl。已知Fe(SCN)3呈红色,则在该平衡体系中加入少量KCl晶体后(忽略溶液体积的变化),红色将
FeCl3+3KSCN Fe(SCN)3+3KCl。已知Fe(SCN)3呈红色,则在该平衡体系中加入少量KCl晶体后(忽略溶液体积的变化),红色将
A、变深 B、变浅 C、不变 D、无法确定
4、下列各反应达平衡后,降压或升温都能使化学平衡向正反应方向移动的是
![]()
![]() A、2NO2(g) N2O4(g);△H<0 B、C(s)+CO2(g) 2CO(g);△H>0
A、2NO2(g) N2O4(g);△H<0 B、C(s)+CO2(g) 2CO(g);△H>0
![]()
![]() C、N2(g)+3H2(g) 2NH3(g);△H<0 D、H2S(g) H2(g)+S(s);△H>0
C、N2(g)+3H2(g) 2NH3(g);△H<0 D、H2S(g) H2(g)+S(s);△H>0
![]() 5、化学反应2X+Y 2Z达化学平衡时,根据以下条件选择正确的选项。
5、化学反应2X+Y 2Z达化学平衡时,根据以下条件选择正确的选项。
(1)升高温度时,Z的量增加,此反应
A、正反应是放热反应 B、正反应是吸热反应
C、没有显著的热量变化 D、原化学平衡没有发生移动
(2)如果X、Y、Z都是气体,达到平衡时减小压强,那么
A、平衡不移动 B、平衡向正反应方向移动C、平衡向逆反应方向移动 D、Z的浓度会增大
(3)如果已知Y是气体,增大压强时,化学平衡向逆反应方向移动,那么
A、X是气体,Z是固体 B、X、Y、Z都是气体
C、X、Z都是固体 D、X是固体,Z是气体
6、下列反应在密闭容器中达到平衡后,升高温度可以使混合气体的平均相对分子质量减小的是
![]()
![]() A、H2(g)+Br2(g) 2HBr(g);△H<0 B、N2(g)+3H2(g) 2NH3(g) ;△H<0
A、H2(g)+Br2(g) 2HBr(g);△H<0 B、N2(g)+3H2(g) 2NH3(g) ;△H<0
![]()
![]() C、N2O4(g) 2NO2(g) ;△H>0 D、4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ;△H<0
C、N2O4(g) 2NO2(g) ;△H>0 D、4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ;△H<0
化学平衡常数及化学平衡计算(两课时)
【考试说明】
1、理解化学平衡常数的含义,
2、能用化学平衡常数计算反应物的转化率。
一、化学平衡常数
(一) 化学平衡常数的理解
1、化学平衡常数定义:
2、平衡常数的数学表达式及单位:
如对于达到平衡的一般可逆反应:aA + bB ![]() pC + qD反应物和生成物平衡浓度表示为C(A) 、 C (B)、C(C) 、C(D)
pC + qD反应物和生成物平衡浓度表示为C(A) 、 C (B)、C(C) 、C(D)
化学平衡常数:K=
[思考与交流] K值的大小说明了什么? 化学平衡常数与哪些因素有关?
3、K值的大小意义:
4、影响化学平衡常数的因素:
(二)化学平衡常数的应用及计算
1、利用平衡常数解释浓度改变对化学平衡的影响。
【例1】A 、B、 C、D为四种易溶物质,它们在稀溶液中建立如下平衡:A+2B+H2O![]() C+D。当加水稀释时,平衡向 (填“正”或“逆”)反应方向移动,理由是
C+D。当加水稀释时,平衡向 (填“正”或“逆”)反应方向移动,理由是
2、利用平衡常数解释压强改变对化学平衡的影响
【例2】在密闭容器中进行的如下反应:2SO2(g)+O2(g)![]() 2SO3(g)。SO2的起始浓度是0.4mol/l, O2的起始浓度是1mol/l,当SO2的转化率为80%时,反应达到平衡状态.
2SO3(g)。SO2的起始浓度是0.4mol/l, O2的起始浓度是1mol/l,当SO2的转化率为80%时,反应达到平衡状态.
(1)求反应的平衡常数
(2)若将平衡时反应混合物的压强增大1倍,平衡将如何移动?
(3)若将平衡时反应混合物的压强减少1倍,平衡将如何移动?
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡又将如何移动?
3、利用平衡常数判断反应的热效应和比较反应速率及求解转化率
(1)若升高温度,K值增大,则正反应为 热反应
(2)若升高温度,K值减小,则正反应为 热反应
【例3】在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:(1)该反应的化学平衡常数K = 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =0.01mol/L, c(H2O) =0.03mol/L, c(CO2) =0.01mol/L, c(H2) =0.05mol/L ,则反应开始时,H2O的消耗速率比生成速率 (填"大""小"或"不能确定")
(4)830℃,在1L的固定容器的密闭容器中放入2molCO2和1molH2,平衡后CO2的转化率为 , H2的转化率为 .
二、化学平衡的相关计算:
1、计算步骤:建立模式、确定关系、依据题意、列出方程。
![]() 例如以下反应:mA(g)+nB(g) pC(g)+qD(g),令A、B起始物质的量分别为amol、bmol,达到平衡后,A的物质的量变化为mxmol。
例如以下反应:mA(g)+nB(g) pC(g)+qD(g),令A、B起始物质的量分别为amol、bmol,达到平衡后,A的物质的量变化为mxmol。
![]() mA(g) + nB(g) pC(g) + qD(g)
mA(g) + nB(g) pC(g) + qD(g)
起始量(mol):
变化量(mol):
平衡量(mol):
2、计算类型
1)、转化率的计算:2)、各组分的体积分数或物质的量分数的计算:
3)、气体平均相对分子质量(或平均摩尔质量)的计算:
3、计算方法(三步曲):一般三步曲与差量法,常用关系与定律(阿氏定律及推论)
【例4】在3L的密闭容器中,1mol N2和3mol H2在一定条件下反应,2s后反应达到平衡,测得平衡混合气为3.4mol。下列计算结果正确的是 ( )
A、混合气体物质的量之比为n(N2)∶n(H2)∶n(NH3)=1∶3∶2
B、N2的转化率为30%
C、NH3的体积分数为15%
D、2s内用H2的浓度变化表示的平均反应速率为1.5mol·L—1·s—1
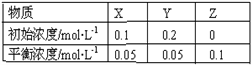 感悟高考:1(09年海南)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误
感悟高考:1(09年海南)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
![]() 2、恒温下,将a mol N2与b mol H2的混合气体通入一个容积固定的密闭容器中发生如下反应: N2(g)+3H2(g) 2NH3(g)
2、恒温下,将a mol N2与b mol H2的混合气体通入一个容积固定的密闭容器中发生如下反应: N2(g)+3H2(g) 2NH3(g)
(1)若反应进行到某一时刻t时,n(N2)=13mol,n(NH3)=6mol,则a=
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的体积分数为25%,计算平衡时NH3的物质的量
(3)原混合气体与平衡混合气体的总物质的量之比n(始)∶n(平)=
(4)原混合气体中,a∶b=
(5)达到平衡时,N2与H2的转化率之比为:α(N2)∶α(H2)=
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=
3.反应2A(g)+B(g)![]() 3C(g),起始时按5∶2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%,求:
3C(g),起始时按5∶2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%,求:
(1)A、B的转化率。
(2)平衡时混合气体的平均相对分子质量〔设A的相对分子质量为Mr(A),B的相对分子质量为Mr(B)〕。
(3)平衡时压强与起始时相比,有何变化?