化学平衡移动图像 (两课时)
【考试说明】
1、从函数关系角度分析化学反应速率及化学平衡问题。
2、能运用化学平衡移动原理对化学平衡的移动进行分析。
一、解答化学平衡图像题的一般方法
(1)在相同温度下,对有气体参加的反应而言,压强越大到达平衡所需的时间越短;在相同压强下,温度越高,到达平衡所需的时间越短(即“先拐先平”)

![]() 【例1】反应A(g)+B(g) C(g)+D(g)(正反应为吸热反应)分别在673K和373K时进行,得到C的体积分数和时间的关系曲线如图所示。其中能正确表示此反应的图像的是 ( )
【例1】反应A(g)+B(g) C(g)+D(g)(正反应为吸热反应)分别在673K和373K时进行,得到C的体积分数和时间的关系曲线如图所示。其中能正确表示此反应的图像的是 ( )
(2)平衡向正反应方向转动,生成物的产量增加,但生成物的浓度,生成物的百分含量,反应物的转化率都不一定增加。
【例2】如图所示为可逆反应A(g)+2B(g)![]() 2C(g);△H>0的平衡移动关系曲线,下列说法正确的是
2C(g);△H>0的平衡移动关系曲线,下列说法正确的是
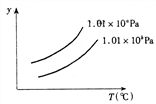 A、a<b,y轴指B的百分含量
A、a<b,y轴指B的百分含量
B、a<b,y轴指A的转化率
C、a>b,y轴指C的百分含量
D、a>b,y轴指A的转化率
(3)加入催化剂,只能同等倍数改变正、逆反应速率,改变达到平衡所需的时间,但不影响化学平衡。
![]() 【例3】已知某可逆反应在密闭容器中进行:A(g)+2B(g) 3C(g)+D(s)(正反应为放热反应)。
【例3】已知某可逆反应在密闭容器中进行:A(g)+2B(g) 3C(g)+D(s)(正反应为放热反应)。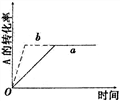 下图中曲线a代表一定条件下该反应的过程,若使曲线a变为b曲线,可采取的措施是( )
下图中曲线a代表一定条件下该反应的过程,若使曲线a变为b曲线,可采取的措施是( )
A、增大A的浓度 B、缩小容器的体积
C、加入催化剂 D、升高温度
二、化学平衡图像的常见类型
1、时间(t)类
![]() 【例4】在密闭容器中,一定条件下进行反应:mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
【例4】在密闭容器中,一定条件下进行反应:mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,![]() 变化过程如图所示,则对该反应叙述正确的是 ( )
变化过程如图所示,则对该反应叙述正确的是 ( )
 A、正反应是吸热反应 B、逆反应是吸热反应
A、正反应是吸热反应 B、逆反应是吸热反应
C、m+n>p+q D、m+n<p+q
2、温度(T)类
![]() 【例5】反应X(g)+3Y(g) 2Z(g)(正反应为放热反应),在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为图中的
【例5】反应X(g)+3Y(g) 2Z(g)(正反应为放热反应),在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为图中的

3、压强(P)类
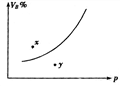 【例6】可逆反应:mA(s)+nB(g)
【例6】可逆反应:mA(s)+nB(g)![]() qC(g), △H<0在一定温度的密闭容器中进行,B的体积百分含量(VB%)与压强关系如图所示,下列叙述正确的是 ( )
qC(g), △H<0在一定温度的密闭容器中进行,B的体积百分含量(VB%)与压强关系如图所示,下列叙述正确的是 ( )
A、m+n<q B、n>q
C、n<q D、x点V正>V逆
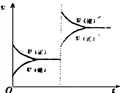
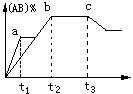 7.反应A2+B2
7.反应A2+B2![]() 2AB在不同温度和压强改变的条件下产物AB的生成情况如图所示,a为500℃,b为反应在300℃时情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
2AB在不同温度和压强改变的条件下产物AB的生成情况如图所示,a为500℃,b为反应在300℃时情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
A.A2、B2、AB均为气体,△H<0
B.AB为气体,A2、B2中有一种为非气体,△H<0
C.AB为气体,A2、B2中有一种为非气体,△H>0
D.AB为固体,A2、B2中有一种为非气体,△H<0
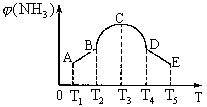 8.在容积相同的不同密闭容器内,分别充入同量的
8.在容积相同的不同密闭容器内,分别充入同量的![]() ,在不同温度,任其发生反应
,在不同温度,任其发生反应![]()
![]()
![]() ,在第7秒时分别测定其中
,在第7秒时分别测定其中![]() 的体积分数
的体积分数![]() ,并绘成下图曲线。
,并绘成下图曲线。
(1)A、B、C、D、E中,尚未达到化学平衡状态的点是________。
(2)此反应的正反应是______热反应。
(3)AC段曲线是增函数曲线,CE段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为____________________________________________________。
![]() (4)
(4)
v正_____v逆
9(1)反应![]()
![]()
![]() 在一容积固定不变的容器内进行,反应达到平衡后。(以下填增大、减少或不变) <1>若
在一容积固定不变的容器内进行,反应达到平衡后。(以下填增大、减少或不变) <1>若![]() ,增大A的浓度,A的转化率________。
,增大A的浓度,A的转化率________。
<2>若![]() ,增大A的浓度,A的转化率______。
,增大A的浓度,A的转化率______。
(2)若将反应改为![]()
![]()
![]() ,容器体积固定不变,且起始时A与B的物质的量之比为
,容器体积固定不变,且起始时A与B的物质的量之比为![]() <1>平衡时A与B的转化率之比是_________。
<1>平衡时A与B的转化率之比是_________。
<2>若增大A的浓度,则A的转化率_________。
<3>若同时同等倍数地增大A、B的浓度,则![]() 与
与![]() 满足什么关系时,A与B的转化率同时增大?
满足什么关系时,A与B的转化率同时增大?![]() 。
。
10.(2011全国II卷)反应aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容条件下进行。
cC(g)(ΔH<0)在等容条件下进行。
改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题: (1) 反应的化学方程式中,a:b:c为_____________;
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为_________;
(3)B的平衡转化率αI(B)、αⅡ(B)、αⅢ(B)中最小的是_____,其值是__________;
(4) 由第一次平衡到第二次平衡,平衡移动的方向是______,采取的措施是________;
(5) 比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”“=”),判断的理由是_________________________________________;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。

答案:(1)1:3:2 (2)VI(A)VⅡ(A)VⅢ(A) (3)αⅢ(B) 19% (4)向正反应方向 从反应体系中移出产物C (5) > 此反应为放热反应,降低温度,平衡向正反应方向移动