11.(15分)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的氯化铁溶液中加入少量的NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作最可能成功的同学是________,他的操作中涉及的化学方程式为______________________。
(2)设计最简单的方法证明有Fe(OH)3胶体生成,实验操作和现象是______________________________。利用了胶体具有________(填性质)。
(3)已知胶体微粒吸附异种电荷。在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现靠近阴极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带________(带“正”或“负”)电荷。
②向其中加入饱和NaHSO4溶液,产生的现象是________________________。
解析:(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+3H2O△Fe(OH)3(胶体)+3HCl,甲、乙两同学的做法都不能生成胶体,得到的是Fe(OH)3沉淀。
(2)胶体具有丁达尔效应,可用丁达尔效应进行验证。当用激光笔照射时,若看到一条光亮的“通路”,说明有胶体生成。
(3)①通电后,阴极附近的颜色逐渐变深,说明Fe(OH)3胶粒向阴极移动,Fe(OH)3胶粒带有正电荷。
②由于Fe(OH)3胶粒带有正电荷,加入饱和NaHSO4溶液后,SO中和了Fe(OH)3胶粒所带的正电荷,使Fe(OH)3胶体发生聚沉;NaHSO4显强酸性,其电离出来的H+能与Fe(OH)3沉淀发生酸碱中和反应而使Fe(OH)3沉淀溶解。
答案:(1)丙 FeCl3+3H2O△Fe(OH)3(胶体)+3HCl
(2)用激光笔照射,若看到有一条光亮的“通路”,证明有Fe(OH)3胶体生成 丁达尔效应
(3)①正 ②先出现红褐色沉淀,后沉淀消失
12.(10分)FeCl3的水溶液滴入沸水可得到以Fe(OH)3为分散质的红褐色胶体。
(1)该红褐色胶体中Fe(OH)3粒子的直径大小范围是__________________________。
(2)FeCl3溶液滴入沸水可得到Fe(OH)3红褐色胶体的反应的化学方程式是______________________________________________________________________。
(3)此分散系不具有的性质是__________(填字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.FeCl3溶液中溶质离子可以通过半透膜,Fe(OH)3胶体中分散质粒子则不能通过半透膜
解析:(1)胶体中分散质粒子的直径介于1 nm~100 nm之间。
(2)FeCl3水解生成Fe(OH)3胶体的化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。
(3)胶体具有丁达尔效应,Fe(OH)3胶体粒子带正电荷,能发生电泳现象,Fe(OH)3胶体不能通过半透膜,但FeCl3溶液中的溶质能通过半透膜。向Fe(OH)3胶体中加入电解质溶液,能发生聚沉现象。
答案:(1)1 nm~100 nm
(2)FeCl3+3H2OFe(OH)3(胶体)+3HCl
(3)c
13.(15分)以下是依据一定的分类标准对某些物质与水反应的情况进行分类的分类图。请根据你所学的知识,按要求填空。
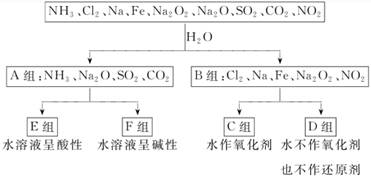
(1)上述第一次分类的依据是__________________。
(2)C组中的某一物质在常温下能与冷水反应,写出该反应的化学方程式:______________________。
(3)任选D组中的一种物质,写出1点其重要用途______________________。
(4)F组物质中某一物质的水溶液呈弱碱性,原因是______________________(用电离方程式表示)。
(5)D组中某一物质与E组中某一物质在水中发生反应生成两种强酸,写出该反应的离子方程式:____________________________。
解析:(1)A组中的物质与水反应发生的不是氧化还原反应,B组中的物质与水反应发生氧化还原反应。(2)Na和H2O在常温条件下发生剧烈反应生成NaOH和H2。(3)Cl2、Na2O2、NO2与水反应时,水既不是氧化剂,也不是还原剂。氯气可用于制作漂白剂、消毒剂;过氧化钠可作供氧剂;二氧化氮可用于生产硝酸。(4)氨水中的NH3·H2O发生电离生成OH-,溶液显碱性。(5)Cl2与SO2在水中发生氧化还原反应生成H2SO4和HCl。
答案:(1)水与的反应是否为氧化还原反应
(2)2Na+2H2O===2NaOH+H2↑
(3)Cl2:消毒剂(或Na2O2:供氧剂,NO2:生产硝酸)
(4)NH3·H2ONH+OH-
(5)Cl2+SO2+2H2O===2Cl-+SO+4H+