1、人体血红蛋白中含有Fe2+。如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+。生成高铁血红蛋白而丧失与氧气结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )。
A.酸性 B.碱性 C.氧化性 D.还原性
2.下列变化需加入氧化剂才能实现的是( )
A.CuO→Cu B.CaCO3→CaO C.Fe→FeCl2 D.HCl→Cl2
3、根据下反应:⑴Fe+CuCl2=FeCl2+Cu ⑵2FeCl3+Cu=2FeCl2+CuCl2,
判断:FeCl3、FeCl2、CuCl2氧化性强弱的顺序是 ( )
A.FeCl3> FeCl2 > CuCl2 B.FeCl2 > CuCl2 > FeCl3
C.FeCl3> CuCl2 > FeCl2 D.CuCl2 > FeCl3> FeCl2
4、已知还原性:Cl—<Br—<Fe2+<I—<SO2,由此判断下列反应能够发生的是( )
①2Fe3++SO2+2H2O=2Fe2++SO42—+4H+
②I2+SO2+2H2O=4H++ SO42—+2I—
③2Fe2++I2=2Fe3++2I—
④2Br—+4H++ SO42—=SO2↑+Br2+2H2O
A.①② B.②③ C.③④ D.①④
5、在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可知,在RO3n-中,元素R的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
6、由于易被氧化而不宜****存放的溶液是( )
A.高锰酸钾溶液 B.硝酸银溶液 C.硫酸亚铁溶液 D.氯化铁溶液
7、过量的铁与硝酸反应,反应后铁有剩余,溶液中存在的主要阳离子是( )
A.Fe3+ B.Fe2+ C.Fe2+和Fe3+ D.H+
8、下列离子方程式中,正确的是 ( )
A.铁与稀氯化铁溶液反应:Fe+Fe3+==2Fe2+ B.铁与稀盐酸反应:2Fe+6H+==2Fe2++3H2↑
C.FeCl2溶液与氯水反应:Fe2++Cl2==Fe3++2Cl- D.Fe(OH)3与盐酸反应:Fe(OH)3+3H+==Fe3++3H2O
9、能大量共存于同一溶液中的两种离子是( )
A.Fe3+和I- B.Fe2+和S2- C.Fe2+和Cu2+ D.Fe2+和Fe3+
10、为了除去FeSO4溶液中的Fe2(SO4)3和CuSO4,****选用( )
A.烧碱溶液 B.浓氨水 C.镁粉 D.铁粉
11、下列物质反应后,滴入KSCN溶液显红色的是 ( )
A、Fe+HCl B.过量铁+稀硝酸 C.FeCl2+Cl2 D.Fe+CuSO4
12、将8.4 g铁粉和3.2 g硫均匀混合加热反应,冷却后加入足量的盐酸,在标准状况下收集到气体的体积是 ( ) A.1.12 L B.2.24 L C.3.36 L D.1.2 L
13、将铁片加到1 L 0.5 mol/L FeCl3溶液中,当Fe2+和Fe3+的浓度相等时,铁片的质量减少( )
A.2.8 g B.5.6 g C.11.2 g D.1.4 g
14、铁、镁、铝3种金属分别和同体积同浓度的盐酸反应,同温同压下产生相同体积的氢气,则参加反应的金属 ( )
A.所失去的电子数目相等 B.质量相等 C.物质的量相等 D.质量比是28:12:9
15、能证明溶液中含有Fe2+的实验是 ( )
A.向溶液中加氨水,先生成白色沉淀,最后转变为红褐色沉淀
B.向溶液中通人氯气后,再滴入KSCN溶液,原溶液变红色
C.向溶液中滴入NaOH溶液,生成红褐色沉淀 D.向溶液中滴入KSCN溶液,溶液变红色
16、把铁、铜、氯化铁、氯化亚铁、氯化铜溶液放在一起,反应后铁有剩余,则溶液中含有的最多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
17、将Na2O2投入FeCl2溶液中,可观察到的现象是( )
A.生成白色沉淀 B.生成红褐色沉淀 C.有气泡产生 D.无变化
18、水(H2O)在很多化学反应中起极其重要的作用。请研究下列水参与的氧化还原反应:
①NaH+H2O==NaOH+H2↑ ②2Na2O2+2H2O==4NaOH+O2↑
③2Na+2H2O==2NaOH+H2↑ ④3NO2+H2O==2HNO3+NO![]()
⑤2H2O 2H2↑+O2↑ ⑥2F2+2H2O==4HF+O2↑
(1)水只做氧化剂的是 ;水只做还原剂的是 ;水既做氧化剂又做还原剂的是 ;水既不是氧化剂又不是还原剂的是 。
(2)水做氧化剂时,被还原的元素是 ,水做还原剂时,被氧化的元素是 。
19、![]() KMnO4 +
KMnO4 + ![]() HCl(浓) ====
HCl(浓) ==== ![]() MnCl2 +
MnCl2 + ![]() Cl2↑+
Cl2↑+ ![]() KCl +
KCl + ![]() H2O
H2O
①标出化合价并配平,用单/双线桥标出该反应的电子转移。
②氧化剂 ,还原剂 ,氧化剂与还原剂物质的量之比为 。
③氧化产物 ,还原产物 。
④浓盐酸表现 性和 性,其物质的量之比为 。
⑤氧化性: > ,还原性: > 。
⑥制得标况下5.6升氯气,电子转移总数为 。
20.实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题: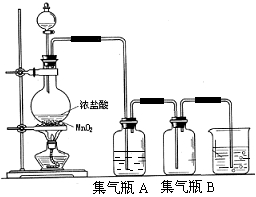
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
21、在新制的氯化亚铁溶液中,加入几滴硫氰化钾溶液,溶液 色,若加入几滴氯水,溶液呈 色,有关的离子方程式为 。
22、除去FeCl3溶液中的少量FeCl2,可采用试剂 ,化学方程式为 ;离子方程式为 。
23、将单质铁、铜与FeCl3、FeCl2、CuCl2溶液一起放进烧杯中,在下列情况下,指出有哪种阳离子(不考虑阴离子)或金属单质同时存在,填在空白处。
(1)充分反应后,铁有剩余,则容器内还可能有 ;
(2)若充分反应后,容器内有相当量的Cu2+,则可能还有 ;
(3)除Cu2+外,还有相当量的Cu,则可能还有 。