1.(2014上海卷)今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有 ( )
A.碱性:KOH>NaOH B.相对分子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
【答案】B
2.(2014山东卷)根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.17Cl与17Cl得电子能力相同
【答案】D
【解析】根据原子结构和元素周期律判断元素性质的递变规律,含氧酸酸性强弱、化学性质的判断、离子半径的比较、得电子能力的判断。A项没有指明****价含氧酸,错误;B项核外电子排布相同的微粒可以是分子、原子或离子,如O2-、H2O、HF、Ne、Na+、Mg2+等化学性质不相同,错误;C项S2-半径大于Cl-,错误;D项17Cl与17Cl都是氯原子,得电子能力相同,正确。解答时应根据元素周期律进行分析,注意把握关键的字词,如比较含氧酸的酸性是否指明了****价,微粒既包括分子、原子,也包括离子等,比较离子半径时要理解离子核外电子排布相同的递变规律。
3.下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
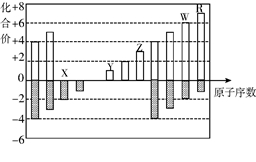
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者****价氧化物对应的水化物不能相互反应
【答案】B
【解析】依据元素化合价规律可知X、Y、Z、W、R分别是氧、钠、铝、硫、氯元素。A项,原子半径Na>Al>O(即Y>Z>X);C项,SO3(WX3)和水反应生成的H2SO4为共价化合物;D项,Al(OH)3具有两性,能与NaOH发生反应生成NaAlO2。
题组二 “位—构—性”的关系及应用
4.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
X |
Y |
Z |
M |
R |
Q | |
|
原子半径(×10-10 m) |
1.86 |
0.99 |
1.43 |
1.60 |
0.75 |
0.74 | |
|
主要化合价 |
****正价 |
+1 |
+7 |
+3 |
+2 |
+5 |
— |
|
最低负价 |
— |
-1 |
— |
— |
-3 |
-2 | |
下列说法不正确的是 ( )
A.元素X和Q形成的化合物中可能含有共价键
B.X、Z、R的****价氧化物的水化物之间可两两相互反应
C.R3-比Q2-更容易失去电子
D.M(OH)2的碱性比XOH的碱性强
【答案】D
【解析】依表格中的数据,推断X、Y、Z、M、R、Q分别为Na、Cl、Al、Mg、N、O。Na与O形成的化合物Na2O2中含有共价键,A正确;NaOH、Al(OH)3、HNO3可两两相互反应,B正确;O2的氧化性大于N2,所以N3-比O2-更容易失去电子,C正确;Mg的金属性弱于Na,所以Mg(OH)2的碱性比NaOH的碱性弱,D错误。
5.(2015山西一模)已知W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z同周期,W、Z同主族,其中X、Y为金属元素,W与Y的原子序数相差5。下列说法正确的是( )
A.X离子的氧化性大于Y离子
B.W的气态氢化物的稳定性比Z的弱
C.含Y的盐溶液一定显酸性
D.X离子的半径小于W离子
【答案】D
【解析】由W与Y的原子序数相差5,Y为金属元素,若Y为Na,W为C,则X为非金属,不满足;若Y为Mg,W为N,X可以为Na,Z为P满足;若Y为Al,W为O,则X可以为Mg或Na,Z为S满足。同周期元素从左至右,金属元素的金属性减弱,所以X离子的氧化性小于Y离子,A错误;同主族非金属元素从上到下非金属性减弱,对应氢化物的稳定性减弱,B错误;Y可以是Mg或Al,其盐溶液不一定显酸性,C错误。
6.(2014大纲卷)A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其****价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是____________,写出一种工业制备单质F的离子方程式:________________________________________________________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为________________,其水溶液与F单质反应的化学方程式为________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显________色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
|
物质 |
组成和结构信息 |
|
a |
含有A的二元离子化合物 |
|
b |
含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
|
c |
化学组成为BDF2 |
|
d |
只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为____________;c的电子式为___________ _________;d的晶体类型是________________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为________。
(1)第一周期第ⅠA族 2Cl-+2H2O电解2OH-+H2↑+Cl2↑[或2NaCl(熔融)电解2Na+Cl2↑]
(2)纯碱(或苏打) 2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3 紫
(3)NaH Na2O2和Na2C2
∶·· ∶∶O∶ ∶·· ∶ 金属晶体
(4)氢 正四面体
解题时要根据信息推导出所有元素,并根据这些元素应用元素周期律、元素及其化合物知识分析回答相关问题。根据“非金属元素A最外电子数与其周期数相同”确定A为氢元素,然后根据其他信息推出B为碳元素,D为氧元素,E为钠元素,F为氯元素。
