1.下列叙述中一定能判断某化学平衡发生移动的是 ( )
A.混合物中各组分的浓度改变
B.正、逆反应速率改变
C.混合物中各组分的含量改变
D.混合体系的压强发生改变
解析:如果混合物中各组分的浓度变化而各组分的含量不变,则平衡不发生移动;使用合适的催化剂,正、逆反应速率都改变,但平衡不移动;如果反应前后气体总物质的量不变,则压强对平衡无影响。
答案:C
2.(2013年江西省丰、樟、高、宜四市联考)下列说法中正确的是 ( )
A.熵增加且放热的反应一定是自发反应
B.自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应
C.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应
D.非自发反应在任何条件下都不能发生
解析:熵增加且放热的反应一定是自发反应,因为ΔH-TΔS<0,故A项正确;有些熵减的过程也能自发进行,非自发反应熵不一定减小或不变,B项错误;放热反应不一定都是自发进行的反应,有些吸热反应也能自发进行,如CH3COOH+NH4HCO3===CH3COONH4+CO2↑+H2O,C项错误;有些吸热反应,在室温下不能自发进行,但在较高温度下能自发进行,D项错误。
答案:A
3.在恒温、恒容的条件下,有反应2A(g)+2B(g)C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2 mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6 mol/L,则以下叙述正确的是 ( )
A.两途径最终达到平衡时,体系内混合气的浓度相同
B.两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,途径Ⅰ的反应速率v(A)等于途径Ⅱ的反应速率v(A)
D.达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的1/2
解析:分析反应特点,反应前后气体分子数不变,把途径Ⅱ中的C、D的浓度转化为A、B的浓度,都是4 mol/L二者为等效平衡,混合气的百分组成相同,浓度不同A项、B项都不正确。由于途径Ⅱ中A的浓度大,故反应速率大,C不正确,恒容条件下,途径Ⅱ的浓度为Ⅰ的2倍,故其密度也是Ⅰ的2倍,D项正确。
答案:D
4.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是 ( )
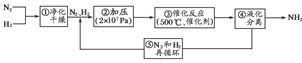
A.①②③ B.②④⑤
C.①③⑤ D.②③④
解析:其反应为N2+3H22NH3,该过程放热。①净化气体目的是防止催化剂中毒;②增压利于平衡右移,可提高原料转化率;③催化剂不能改变平衡,即不能改变原料的转化率;④分离产物平衡向产物方向移动,原料转化率提高;⑤将未转化的原料循环重复转化,可以提高原料转化率;故选B。
答案:B
5.(双选)(2012年南京、盐城市一模)在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
平衡常数与温度的关系
|
温度/℃ |
25 |
80 |
230 |
|
平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法不正确的是 ( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
解析:由表格中数据可看出,温度升高,化学平衡常数减小,即平衡向逆反应方向移动,则正反应是放热反应,A项错误;B项中反应与题干中反应的平衡常数互为倒数,故正确;由c4(CO)=0.54=8>2,则反应向逆反应方向进行,则v(正)<v(逆),C项错误;D项,CO为0.3 mol,浓度为1 mol/L,根据80℃时平衡常数为2,则c[Ni(CO)4]=2 mol/L,正确。
答案:AC
6.(2012年北京东城二模)T℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是 ( )
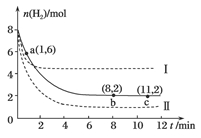
A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应ΔH>0
C.曲线Ⅱ对应的条件改变是减小压强
D.T℃时,该反应的化学平衡常数为0.125
解析:本题主要考查反应速率、平衡移动、平衡常数的计算等知识点。A项,反应开始至a点时v(H2)=2 L=1 mol·L-1·min-1,正确;B项,曲线Ⅰ和实线对比,升温,平衡时H2的物质的量变大,说明平衡逆向移动,该反应ΔH<0,错误;C项,曲线Ⅱ和实线对比,平衡时H2的物质的量变小,说明平衡正向移动,对应的条件改变是增大压强,错误;D项,平衡时c(H2)=1 mol·L-1,c(CO2)=2 mol·L-1,c(CH3OH)=c(H2O)=1 mol·L-1,K=c(CO2)·c3(H2)=2×13=0.5,错误。
