13.短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层的p能级中有3个未成对电子。
(1)C元素原子基态时的价电子排布式为________,若A元素为非金属元素,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(2)当n=2时,B的最简单气态氢化物的分子构型为________,中心原子的杂化方式为________,BC2属于________分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于________晶体。
(3)若A元素的原子最外层电子排布式为2s1,B元素的原子价电子排布式为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序为___________________________________________________(填元素符号)。
(4)右图为C元素与钛、钙元素形成的某晶体结构中的最小重复单元,该晶体中每个钛原子周围与它最近且距离相等的钙离子有________个,该晶体的化学式为_____________________________________________
___________________________。

 【答案】 (1)2s22p4 σ (2)正四面体 sp3 非极性 原子
【答案】 (1)2s22p4 σ (2)正四面体 sp3 非极性 原子
(3)N>O>Si>Li (4)8 CaTiO3
14.铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
水溶液通入SO2白色沉淀
足量10 mol·L-1硫酸
①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中****燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子体原理,O3分子的空间构型为________。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为___________________________________________________。
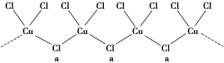
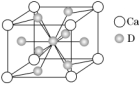
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留两位有效数字)。
 【答案】 (1)①1s22s22p63s23p63d10(或Ar]3d10) N>O>S
【答案】 (1)①1s22s22p63s23p63d10(或Ar]3d10) N>O>S
②AC (2)V形 (3)sp3杂化 (4)5 0.083 g·cm-3
15.Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的****能层符号为________,该能层具有的原子轨道数为________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H22NH3实现储氢和输氢。下列说法正确的是________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4与PH4、CH4、BH4、ClO4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是
____________________________________________________________。
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。

(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则与Na+次近邻的Cl-个数为________,该Na+与跟它次近邻的Cl-之间的距离为________。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为________。(用含a、b的式子表示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为________。
 【答案】 Ⅰ.(1)M 9 (2)cd
【答案】 Ⅰ.(1)M 9 (2)cd
(3)N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向氟原子,偏离氮原子,使得氮原子上的孤电子对难以与Cu2+形成配位键
Ⅱ.(1)8 r (2)3×(a+b)3×100%
(3)26%或213×100%